Deutsche Gesellschaft für Biomaterialien (DGBM)
Jahrestagung 2008 20.-22. November
in Hamburg
Tagungspräsident Prof. Dr. med. J.M. Rueger
Klinik und Poliklinik für Unfall-, Hand- und Wiederherstellungschirurgie
Martinistraße 52 · 20246 Hamburg
Wissenschaftliche Leitung Prof. Dr. med. J.M. Rueger
Dr. med. J.-P. Petersen Dr. med. S. Seitz
H . H M
g 2 BlOmaterialien 9 (3/4), 2008
ABSTRACTS
Vorstand der Deutschen Gesellschaft für Biomaterialien e.V.
Amtierender Vorsitzender:
Prof. Dr.-Ing. habil. H. Worch Institut für Werkstoffwissenschaft
Technische Universität Dresden 01062 Dresden
Tel.: 0351-4633 4336 Fax.: 0351-4633 7129
E-Mail: hworch@rcs.urz.tu-dresden.de
Stellvertretender Vorsitzender:
Prof. Dr. med. J.M. Rueger
Klinik und Poliklinik f ü r Unfall-, Hand- und Wiederherstellungschirurgie Universitätsklinikum Hamburg-Eppendorf
Martinistraße 52 20246 Hamburg Tel.: 040-42803 3459
Fax.: 040-42803 569
E-Mail: rueger@uke.uni-hamburg.de
Schatzmeister:
Dr.-Ing. H.A. Richter M E D I C Inform G m b H Schweilbacher Straße 59
52146 Würselen Tel.: 02405-82746 Fax.: 02405-897498
E-Mail: harichter@post.rwth-aachen.de
Schriftführerin:
Prof. Dr. med. vet. Α. Ignatius
Institut für Unfallchirurgische Forschung und Biomechanik Universität Ulm
Helmholtzstraße 14 89081 Ulm Tel.: 0731-5002 3489 Fax.: 0731-5002 3498
E-Mail: anita.ignatius@medizin.uni-ulm.de
Vorstandsmitglied für „besondere Aufgaben":
Prof. Dr. C.J. Kirkpatrick, MD, PhD, DSc Kliniken der Johannes Gutenberg-Universität
Institut für Pathologie Langenbeckstraße 1
55101 Mainz
E-Mail: kirkpatrick@pathologie.klinik.uni-mainz.de
g | B I O m a t e r i a l i e n 9 (3/4), 2008
AUTOREN
Maximilian Amberger Dr. Dr. Felix Blake Ulrike Deisinger
ZMK - Klinik der Universität Universitätsklinikum Universität Bayreuth
Würzburg Hamburg-Eppendorf Universitätsstr. 30
Abteilung f ü r MKG-Chirurgie 95440 Bayreuth
Funktionswerkstoffe der Martinistr. 52
Medizin und Zahnmedizin 20246 Hamburg Florian Despang
Pleicherwall 2 Technische Universität
97070 WUrzburg Dr. Karin Blechschmidt Dresden
HNO-Klinik Institute of Materials Science Dipl.-Chem. Thomas Annen Biomateriallabor Budapester Str. 27
Universität Duisburg-Essen Lessingstr. 2 01062 Dresden
Anorganische Chemie 07743 Jena Universitätsstr. 5-7
45117 Essen Dr. med. Boris-George Rainer Detsch
Bottenberg BioCer Entwicklungs-GmbH
Dipl.-Biol. Matthias Bartneck MediaPark Klinik Ludwig-Thoma-Str. 36c
Uniklinik Aachen Praxis für Orthopädie 95447 Bayreuth
IZKF B i o M A T Im MediaPark 3
Pauwelsstr. 30 50670 Köln Nina Ehlert
52074 Aachen Leibniz Universität Hannover
Dr. Gudrun Brandes Institut für Anorganische Prof. Dr.-Ing. Bernd-Arno Medizinische Hochschule Chemie
Behrens Hannover Callinstr. 9
Institut für Umformtechnik und Institut Zellbiologie im 30167 Hannover
Umformmaschinen Zentrum Anatomie
An der Universität Carl-Neuberg-Str. 1 Dr. Andrea Ewald
30823 Garbsen 30625 Hannover ZMK-Klinik der Universität
Würzburg
Dr. Albrecht Berg Annette Breier Abt. für Funktionswerkstoffe
Innovent e.V. Leibniz-Institut für der Medizin und der
Biomaterialien Polymerforschung e.V. Zahnheilkunde
Prüssingstr. 27b Verbundwerkstoffe Pleicherwall 2
07745 Jena Hohe Str. 6 97070 Würzburg
01069 Dresden
Dr. C. Bergemann Elena Fadeeva
University of Rostock Dr.-Ing. Anas Bouguecha Laser Zentrum Hannover e. V Medical Faculty Institut für Umformtechnik und Nanotechnology
Dept. of Cell Biology U mformmaschi nen Hollerithallee 8
Schillingallee 69 An der Universität 2 30419 Hannover
18057 Rostock 30823 Garbsen
Cornelia Fano Dr. Helge Bertram Dimitriya Bozukova Institut für Textil- und
Orthopädische University of Liege Verfahrenstechnik (ITV)
Universitätsklinik Heidelberg Chemistry department, Center Vliesstofftechnologie Sektion Experimentelle for Education and research on Körschtalstr. 26
Orthopädie macromolecules 73770 Denkendorf
Schlierbacher Landstr. 200a Allee de la chimie B6a
69118 Heidelberg Sart-Tilman Dr. Keno Ferlemann
4 0 0 0 Liege (Belgien) Universitätsklinikum
Dr. Silke Besdo Unfallchirurgie
Leibniz Universität Hannover Dr. Ulrike Bulnheim Robert-Koch-Str. 4 0
Institut für Universität Rostock 37075 Göttingen
Mehrphasenprozesse Biomedical Research Centre Callinstr.36 Laboratory of Cell Biology
30167 Hannover Schillingallee 69
18057 Rostock
g ^ BlOmaterialien 9 (3/4), 2008
AUTOREN
uDr. Frank Feyerabend G K S S Forschungszentrum Geesthacht
Abteilung für Makromolekulare Strukturforschung Max-Planck-Str. 1 21502 Geesthacht MSc. Janine Fischer G K S S Forschungszentrum Geesthacht
Abteilung für Makromolekulare Strukturforschung Max-Planck-Str. 1 21502 Geesthacht Andreas Fritsche Universität Rostock Orthopädiche Klinik und Poliklinik
Doberaner Str. 142 18057 Rostock Dr. Kathirvel Ganesan Universität Duisburg-Essen Universitätsstr. 5-7
45117 Essen
Dr. Michael Gelinsky TU Dresden
M B Z / I f W W Budapester Str. 27 01069 Dresden Dr. Shahram Ghanaati
Johannes Gutenberg University Institute of Pathology
Langenbeckstr. 1 55116 Mainz Dr. Christian Gocke Universität Rostock I B M T
Ernst-Heydemann-Str. 6 18057 Rostock
Christina Greulich Berufsgenossenschaftliche Universitätsklinik
Bergmannsheil
chirurgische Forschung Bürkle-de-la-Camp-Platz 1 44789 Bochum
Dipl. Biochem. Steffi Grohmann
Institut für Bioprozess- und Analysenmesstechnik e.V.
Rosenhof
37308 Heilbad Heiligenstadt Dr. Jürgen Groll
R W T H Aachen DWI
Pauwelsstr. 8 52074 Aachen P D Dr. Gerhard Gross Helmholtz-Zentrum für Infektionsforschung (HZI) Signal Transduction and Gene Regulation
Inhoffenstr. 7 38124 Braunschweig Dipl.-Biol. Tim Habijan Berufsgenossenschaftliches Universitätsklinikum Bergmannsheil GmbH Chirurgische Forschung Bürkle-de-la-Camp-Platz 1 44789 Bochum
Anne Hahn
Laser Zentrum Hannover e.V.
Nanotechnologie Hollerithallee 8 30419 Hannover Dr. Jörg Hauser
BG-Universitätsklinikum Bergmannsheil
Plastische Chirurgie Bürkle-de-la-Camp-Plz. 1 44789 Bochum
Dr. med. Aldemar Andres Hegewald
Universitätsmedizin Mannheim Neurochirurgische Klinik Theodor-Kutzer-Ufer 1-3 68167 Mannheim
Prof. Dr. Dr. Kai-Olaf Henkel BwKrankenhaus Hamburg MKG-Chirurgie/Plastischc Operationen
Lesserstr. 180
Erik Heurich FSU Jena, Institut für Materialwissenschaft und Werkstofftechnologie Lehrstuhl für Material Wissenschaft Löbdergraben 32 07743 Jena
Dr. Alexander Hofmann Johannes Gutenberg Universität Mainz Klinik und Poliklinik für Unfallchirurgie
Langenbeckstr. 1 55101 Mainz
Prof. Dr. Anita Ignatius Sanatis G m b H
Helmholtz Straße 14 89081 Rosbach Patricia Janicki
Orthopädische Uniklinik Heidelberg
Schlierbacher Landstr. 200a 69118 Heidelberg
Dr. med. Andreas Jokuszies Medizinische Hochschule Hannover
Carl-Neuberg-Str. 1 30625 Hannover Daniela Jörn Bundesanstalt für Materialforschung und - prüfung B A M
Biomaterialien und Implantate Unter den Eichen 44-46 12203 Berlin
Dr. Pascal Jungbluth Universitätsklinikum Düsseldorf
Unfall- und Handchirurgie Moorenstr. 5
40225 Düsseldorf Annika Kasten University of Rostock
Medical Faculty, Laboratory of Cell Biology
Schillingallee 69 18057 Rostock 22049 Hamburg
Q I B I O m a t e i i a l i e n 9 (3/4), 2008
AUTOREN
Christine Kappel Rafael Kucharski Dr. S ü r e y y a M a d e n c i Z M K - Klinik der Universität Leibniz Universitaet H a n n o v e r K l i n i k u m Essen W ü r z b u r g Bereich B i o m e d i z i n t e c h n i k und Physiologische C h e m i e
Abteilung f ü r Leichtbau H u f e l a n d s t r . 55
F u n k t i o n s w e r k s t o f f e d e r An der Universität 2 4 5 1 2 7 Essen Medizin und der 3 0 8 2 3 G a r b s e n
Z a h n h e i l k u n d e Prof. Dr. med. Hans Jörg
Pleicherwall 2 Olga Kufelt Meisel
9 7 0 7 0 W ü r z b u r g Leibniz Universität H a n n o v e r B G - K l i n i k e n B e r g m a n n s t r o s t Institut f ü r A n o r g a n i s c h e N e u r o c h i r u r g i e
Prof. Dr. Doris Klee C h e m i e M e r s e b u r g e r Str. 165
R W T H A a c h e n Callinstr. 9 0 6 1 1 2 Halle
I T M C 3 0 1 6 7 H a n n o v e r
Pauwelsstr. 8 Prof. H e n n i n g M e n z e l
5 2 0 7 4 A a c h e n T o b i a s L a m m e l T e c h n i s c h e C h e m i e
University of G l a s g o w T C M a k r o m o l e k u l a r e r S t o f f e Petra Kleiner Centre for Cell E n g i n e e r i n g H a n s - S o m m e r - S t r . 10 Rechts der Isar/TU M ü n c h e n J o s e p h Black Building 3 8 1 0 6 B r a u n s c h w e i g Orthopädie/Zellkultur G 1 2 8 Q Q G l a s g o w
Ismaninger Str. 22 (Großbritannien) Prof. Rolf M ü l h a u p t
8 1 6 7 5 M ü n c h e n Freiburger
Dr. Frank Linke M a t e r i a l f o r s c h u n g s z e n t r u m Petra J. Kluger S R H Z e n t r a l k l i n i k u m Suhl Ak M ü l h a u p t
F r a u n h o f e r Institut f ü r g G m b H S t e f a n - M e i e r - S t r . 21 G r e n z f l ä c h e n - und Klinik f ü r Kinderchirurgie 7 9 1 0 6 Freiburg B i o v e r f a h r e n s t e c h n i k Albert-Schweitzer-Str. 2
Zellsysteme 9 8 5 2 7 Suhl Prof. Peter M ü l l e r
Nobelstr. 12 H e l m h o l t z - Z e n t r u m f ü r
7 0 5 6 9 Stuttgart Dr. Katrin L o c h n e r I n f e k t i o n s f o r s c h u n g Universität R o s t o c k M B I O
A n n a Kovtun Orthopädische Klinik und I n h o f f e n s t r . 7 Universität D u i s b u r g - E s s e n Poliklinik 3 8 1 2 4 B r a u n s c h w e i g Institut f ü r A n o r g a n i s c h e D o b e r a n e r Str. 142
C h e m i e 18057 R o s t o c k Dr. R a i n e r M ü l l e r
Universitätsstr. 5 - 7 Universität R e g e n s b u r g
4 5 1 1 7 Essen Robert Lösel Institut f ü r Physikalische und
R W T H A a c h e n T h e o r e t i s c h e C h e m i e Sabine K r a m e r Lehrstuhl f ü r T e x t i l c h e m i e und Universitätsstr. 31 Medizinische H o c h s c h u l e M a k r o m o l e k u l a r e C h e m i e 9 3 0 5 3 R e g e n s b u r g
H a n n o v e r Pauwelsstr. 8
Carl-Neuberg-Str. 1 5 2 0 5 6 A a c h e n M i r j a Christine Nolff
3 0 6 2 5 H a n n o v e r S t i f t u n g Tierärztliche
Dr. Frank Luderer H o c h s c h u l e H a n n o v e r Dr. L u d w i k a K r e j a Universität Rostock Institut f ü r Biometrie Universität U l m Institut f ü r B i o m e d i z i n i s c h e B i s c h o f s h o l e r D a m m 15 Institut f ü r U n f a l l c h i r u r g i s c h e Technik 3 0 1 7 3 H a n n o v e r F o r s c h u n g und B i o m e c h a n i k E r n s t - H e y d e m a n n - S t r . 6
Helmholtz Str. 14 18119 R o s t o c k Dr.-Ing. Ingrid Ott
89081 U l m Universität B r e m e n
Dr. Frank Lüthen T e c h n i s c h e M e c h a n i k L e e n a Kruse University of R o s t o c k A m Biologischen Garten 2 Leibniz Universität H a n n o v e r Laboratory for Cell B i o l o g y , 2 8 3 5 9 B r e m e n
Institut f ü r Medical Faculty
M e h r p h a s e n p r o z e s s e Schillingallee 6 9 Dr. A l e k s a n O v s i a n i k o v Callinstr. 36 18057 R o s t o c k Laser Z e n t r u m H a n n o v e r e.V
3 0 1 6 7 H a n n o v e r N a n o t e c h n o l o g i e
Hollerithallee 8 3 0 4 1 9 H a n n o v e r
g ~J BlOmaterlalien 9 (3/4), 2008
AUTOREN
P D Dr. Kirsten Peters Dr. Sebastian Sauerbier Dr. Daniel S k o d a c e k Universität Rostock Uniklinik Freiburg Universitätsklinikum Arbeitsbereich M K G - C i r u r g i e R e g e n s b u r g
Z e l l b i o l o g i e / N a c h w u c h s g r u p p e H u g s t e t t e r Str. 55 H N O - K l i n i k
Schillingallee 6 9 7 9 1 0 6 Freiburg Franz-Josef-Strauss-Allee 11 18057 R o s t o c k
Dr. Lutz Scheideier
9 3 0 5 3 R e g e n s b u r g Cornelia P f a f f e n r o t h Universität T ü b i n g e n Dr. Dr. Ralf S m e e t s
T e c h n i s c h e C h e m i e Dental Clinic, Dept. of Universitätsklinikum Aachen T C M a k r o m o l e k u l a r e r S t o f f e Prosthodontics, Section M W T Klinik f ü r Zahn-, Mund-, H a n s - S o m m e r - S t r . 10 O s l a n d e r Str. 2-8 Kiefer- und Plastische 3 0 1 0 6 B r a u n s c h w e i g 7 2 0 7 6 T ü b i n g e n Gesichtschirurgie;
Interdisziplinäres Z e n t r u m f ü r Dipl.-Ing. R o n n y P f e i f e r S u s a n n e Schlüfter klinische F o r s c h u n g
L a s e r - Z e n t r u m Universität Bayreuth Pauwelsstr. 30
Hollerithallee 8 Friedrich-Baur- 5 2 0 7 4 A a c h e n
3 0 4 1 9 H a n n o v e r Forschungsinstitut f ü r
Biomaterialien Dr. Alexander S. Spiro Igor P o n o m a r e v L u d w i g - T h o m a - S t r . 36 c Universitätsklinikum f z m b G m b H 9 5 4 4 7 Bayreuth H a m b u r g - E p p e n d o r f Tissue E n g i n e e r i n g Z e n t r u m B i o m e c h a n i k und G e r a n i e n w e g 7 O Ä Dr. Gerlind Schneider Skelettbiologie
9 9 9 4 7 B a d L a n g e n s a l z a H N O - K l i n i k Martinistr. 52 B i o m a t e r i a l l a b o r 2 0 2 4 6 H a m b u r g Dr. rer. nat. Uta Reich Lessingstr. 2
M e d i z i n i s c h e H o c h s c h u l e 0 7 7 4 3 Jena Stephanie Steinhaus
H a n n o v e r Leibniz Universität H a n n o v e r
Klinik f ü r H N O - H e i l k u n d e Dr. Ilona Schön Institut f ü r A n o r g a n i s c h e C a r l - N e u b e r g - S t r . 1 Universitätsklinikum der M L U C h e m i e
3 0 6 2 5 H a n n o v e r E r n s t - G r u b e - S t r . 4 0 F G 5 / E 0 1 Callinstr. 9 0 6 1 2 0 Halle 3 0 1 6 7 H a n n o v e r Dipl. Ing. Berna Richter
M e d i z i n i s c h e H o c h s c h u l e Julia S c h ö n e Dipl.-Ing., M S c . Andreas H a n n o v e r M e d i z i n i s c h e H o c h s c h u l e Szentivanyi
L a b o r f ü r B i o m e c h a n i k und H a n n o v e r , H N O Leibniz Universität H a n n o v e r Biomaterialien C a r l - N e u b e r g - S t r . 1 Institut f ü r
O r t h o p ä d i s c h e Klinik 3 0 6 2 5 H a n n o v e r M e h r p h a s e n p r o z e s s e A n n a - v o n - B o r r i e s - S t r . 1-7 Callinstr. 36 3 0 6 2 5 H a n n o v e r Dr. A n n a Schuster
G K S S F o r s c h u n g s z e n t r u m
3 0 1 6 7 H a n n o v e r J ü r g e n Rost G e e s t h a c h t Martina T h o m a n n
iba e.V. W P S Tierärztliche H o c h s c h u l e
F B B i o Werkstoffe M a x P l a n c k Str. 1 H a n n o v e r
R o s e n h o f 2 1 5 0 2 Geesthacht Klinik f ü r Kleintiere
3 7 3 0 8 Heilbad Heiligenstadt Bischofsholer D a m m 15
Janine Schwiertz 3 0 1 7 3 H a n n o v e r A c h i m S a l a m o n Universität D u i s b u r g - E s s e n
Universität Rostock Institut f ü r Anorganische R o m a n Tsaryk Zellbiologie, C h e m i e J o h a n n e s G u t e n b e r g - N a c h w u c h s g r u p p e Universitätsstr. 5 - 7 Universität M a i n z A m K a b u t z e n h o f 45 4 5 1 1 7 Essen Institu f ü r Pathologie
18057 R o s t o c k Langenbeckstr. 1
55101 Mainz Thorsten Sänger
Universitätsklinikum Essen Physiologische C h e m i e Hufelandstr. 55 4 5 1 4 7 Essen
g g BlOmaterialien 9 (3/4), 2008
Franziska Uhl
BioCer Entwicklungs-GmbH Ludwig-Thoma Str. 36c 95447 Bayreuth Dr. Nina von der Höh Tierärztliche Hochschule Hannover
Klinik für Kleintiere Bischofsholer D a m m 15 30173 Hannover Dipl.-Ing. Elke Vorndran Universität Würzburg F M Z
Pleicherwall 2 97070 Würzburg Arne W e i d m a n n University of Rostock Biomedical Research Center Cell Biology
Schillingallee 69 18057 Rostock Dr. Birgit Weyand Medizinische Hochschule Hannover
Plastische, Hand und Wiederherstellungschirurgie, OE 6260
Carl-Neubergstr. 1 30625 Hannover Soenke Wienecke
Leibniz Universität Hannover Institut für
Mehrphasenprozesse Callinstr. 36 30167 Hannover
Thomas Winkler Technische Universität Hamburg Harburg Biomechanik Denicke-Str. 15 21073 Hamburg Jana Wohlgemuth
Institut für Biomedizinische Technik, Zellbiologie Ernst-Heydemann Str. 6
18057 Rostock Dr. Alina Zalfen University Liege C E R M
Sart Tilman B6a 4 0 0 0 Liege (Belgien) Dr. Jian-Tao Zhang
Friedrich-Schiller-Universität Jena
Institute of Material Science and Technology (IMT) Loebdergraben 32 07743 Jena Andreas Zoll
Universitätsklinikum Würzburg F M Z
Pleicherwall 2 97070 Würzburg Dr. Kristin Zurlinden Universitätsklinikum Essen Institut für Physiologische Chemie
Hufelandstr. 55 45122 Essen
PD Dr. Regine Willumeit G K S S Forschungszentrum Geesthacht
Abteilung f ü r Makromolekulare Strukturforschung Max-Planck-Str. 1 21502 Geesthacht
g Q B l O m a t e r i a l i e n 9 (3/4), 2008
ABSTRACTS
^ V O R T R A G E
S. Ghanaati, C. Orth, U. Deisinger, R. Detsch, P. Booms, R. Unger, G. Ziegler, J. Kirkpatrick Vortrag 001
The composition of bone substitute materials influences their bioactivity in vivo Introduction
The biochemical composition of bone substitute materials may play a pivotal role in their degradation and vascularization as well as in enhancing new bone formation. In order to test this hypothesis in vivo, an ectopic model, i.e. without the influence of the residual bone, has been chosen. Previous in vivo studies have shown that hydroxyapatite (HA)-based biomaterials induce a mild inflammatory response along with some vascularization and degradation [1]. Further analyses of tricalcium phosphate (TCP) of different sizes and shapes revealed that the inflammatory response and degradation are associated with these physical biomaterial parameters [2], Therefore, in this study granulates made of HA, TCP and a mixture of 60 wt%
HA and 40 wt% TCP (BCP) of the same shape and size were used in order to evaluate the influence of biomaterial composition on tissue reaction.
Materials and Methods
Dense granulates were made from HA, TCP and a HA/TCP 60/40 wt.% mixture by a non-thermal granulation process and subsequent sintering at 1300
°C. All granulates had a diameter of 0.1 - 0.5 mm.
Using the previously described subcutaneous implantation model [1], 64 female 5-week-old Wistar rats were randomly divided into 4 groups of 16 animals each. The first 3 groups were treated with the above- mentioned granulates (60 mg each animal). Group 4 underwent operation without biomaterial implantation.
At indicated time points (3, 10, 15 or 30 days) after implantation (4 animals at each time) the peri-implant tissue along with the biomaterial were processed for histology.
Discussion
The results of this in vivo study in ectopic tissue emphasize that the biochemical composition of granules for filling bone defects plays a pivotal role regarding its bioactivity. In addition to previous observations [1, 2] it was shown that the phase composition of the bone substitute can influence the vascularization of the peri-implant tissue and might consequently contribute to the activation and formation of cellular components, such as osteoclast-like cells.
These observations are of clinical relevance, especially in the field of maxillofacial surgery.
References
[1] Ghanaati S, Stubinger S, Orth C Biesterfeld, Barbeck Μ, Booms Ρ, Sader R, Kirkpatrick CJ (2007).
Presence of osteoclast-like cells in the subcutaneous tissue of Wistar rats: in vivo biocompatibility analysis of a synthetic HA and Si02 matrix, Poster presentation, 21st European conference on biomaterials. Brighton, England, UK.
[2] Ghanaati S, Orth C and Kirkpatrick CJ (2008). The morphology of ß-TCP- based biomaterials influences their bioactivity in vivo. Tissue Engineering Part A, 14 (8)917-918.
Results
At day 3, the implantation of all biomaterials resulted in a fibrin-rich peri-implant tissue with almost no neutrophilic granulocytes. At day 10, the tissue associated with the granulates changed to a well vascularized fibre-rich tissue, enclosing the particles.
From that time onwards until the end of the study the spherical granulates of all groups remained well embedded and no fibre ingrowth was seen into any of the biomaterials. In contrast to the HA granulates, TCP granulates were better vascularized and considerably more osteoclast-like cells were observed. BCP granulates showed the stability of HA and the bioactivity of TCP.
Q Q BlOmaterialien 9 (3/4), 2008
V O R T R A G E
Τ. Winkler, D. Fritsch, R. Janssen, S. Brink, M. Amling, M.M. Morlock, A.F. Schilling
ABSTRACTS
Vortrag 002
Dreidimensionale Analyse der Resorption von Biomaterialien durch humane Osteoklasten in vitro
Einleitung
Biomaterialien wurden entwickelt um den Selbstheilungsprozess des Körpers zu unterstützen.
Dabei spielt Osseointegration eine Rolle, deren erster Schritt die Resorption des Biomaterials durch Osteoklasten ist. Bislang war es nur möglich diese Resorption näherungsweise durch Röntgenaufnahmen in Tierversuchen zu bestimmen oder die resorbierte Oberfläche in der Zellkultur zu messen. Ziel dieser Studie war es, ein Analysesystem zu entwickeln, mit dem die dreidimensionale Resorption von Biomaterialien durch humane Osteoklasten quantitativ bestimmt werden kann.
Methoden
Zum Aufbau dieses Systems haben wir als Substrate für die osteoklastäre Resorption das üblicherweise genutzte Dentin, sowie einen Kalziumphosphat Zement (KP) gewählt. Pluripotente hämatopoetische Stammzellen wurden aus peripherem humanem Blut isoliert, aufgereinigt und in Anwesenheit der Zytokine M-CSF und RANK-L für 4 Wochen auf den Substraten kultiviert. Die Zellkulturen wurden morphologisch und molekular auf Markerproteine untersucht. Die resorbierte Oberfläche sowie das resorbierte Volumen wurden mittels Fokusvariationsmikroskopie bestimmt.
Alle Experimente wurden im fünffachen Ansatz durchgeführt. Die statistische Auswertung erfolgte mittels ANOVA, dabei wurde p<0,05 als statistisch signifikant angenommen.
Material. Der erste Schritt der Osseointegration ist die Resorption. Möglicherweise erfordern unterschiedliche Frakturtypen oder Patienten mit unterschiedlichem Knochenstoffwechsel den Einsatz von Biomaterial mit ganz bestimmten Resorptionseigenschaften um optimale Osseointegration zu erreichen. Bevor diese Frage geklärt werden kann, müssen in einem ersten Schritt diese Resorptionseigenschaften der verwendeten Materialien bestimmt werden. Das hier vorgestellte System erlaubt dabei sowohl die Messung der Oberflächeresorption, als auch die Bestimmung dreidimensionaler Parameter, wie Resorptionstiefe und Resorptionsvolumen.
Wir zeigen hier, dass unterschiedliche Materialien von humanen Osteoklasten unterschiedlich resorbiert werden. Dies betrifft nicht nur die Oberflächenresorption sondern ebenfalls die Resorptionstiefe. Diese könnte eine wichtige Rolle beim zweiten Schritt der Osseointegration spielen, wenn sich neuer Knochen auf dem Ersatzmaterial bilden soll.
Ergebnisse
Die Zellkulturen bestanden homogen aus multinukleären Zellen, die die osteoklastenspezifischen Marker tatrat-resistente, saure Phosphatase (TRAP) und Carboanhydrase Typ II (CA2) präsentierten. Die Analyse der Resorption zeigte, dass die Oberfläche von Dentin signifikant stärker resorbiert wird als die Oberfläche des KP (p=0,005). Hingegen wurde kein signifikanter Unterschied zwischen den resorbierten Volumina (p=0,21). Unerwartet zeigte die Analyse der Resorptionstiefe tiefere Lakunen im KP als im Dentin (p=0,043).
Diskussion
Osseointegration erlaubt Biomaterialien durch neu den Vorteilen lebenden
graduellen Austausch von gebildeten Knochen mit all Gewebes gegenüber totem
φ 1 | B I O m a t e r i a ] i e n 9 (3/4), 2008
ABSTRACTS
ι ·'VORTRAGE
S. Besdo, F. Thörey, H. Windhagen, A. Meyer-Lindenberg
Vortrag 003
Ermittlung von Materialkennwerten für Kallus durch den Vergleich von in vivo Experimenten mit Finite-Elemente-Simulationen
Einleitung
Für die Entwicklung intelligenter Ostheosynthese- verfahren ist es notwendig, die Materialeigenschaften des Knochens im Verlauf der Heilung zu kennen. Nur so ist es möglich, z.B. gezielt Legierungen für degradable Implantate auszuwählen. Neben der Auswahl des geeigneten Materials spielt aber auch die Geometrie der Implantate eine große Rolle. Um die Anzahl notwendiger Tierversuche zu reduzieren, kann hier auf die Methode der Finiten Elemente zurückgegriffen werden. Für solche Simulationen ist es wiederum notwendig, die Materialkennwerte für den Knochen, aber auch für den Kallus in Abhängigkeit von der Heilungsdauer zu kennen. Hierfür wurden nach Osteosynthesen in vivo Biegeversuche an Kaninchenknochen durchgeführt und diese anschließend mit Hilfe der Methode der Finiten Elemente simuliert, um so Erkenntnisse über den zeitlichen Verlauf der Materialkennwerte zu erlangen.
MicroCT-Aufnahmen unterstützen die Analyse.
In vivo Messungen der Biegesteifigkeit
Wie in [1] beschrieben, wird bei weiblichen Kaninchen der Rasse New Zealand White jeweils die rechte Tibia so durchtrennt, so dass ein 2mm großer Spalt entsteht.
Die Osteotomie wird mit einem bilateralen uniplanaren Fixateur extern stabilisiert. Nach ungefähr drei Wochen wird mit Vier-Punkt-Biegeversuchen an der heilenden Tibia begonnen. Um den Heilungsverlauf gut verfolgen zu können, werden die Messungen zweimal pro Woche durchgeführt. Nach sieben bis neun Wochen werden die Tiere euthanasiert und die osteotomierten Knochen mit Hilfe von microCT-Aufnahmen untersucht.
Diskussion
Die Geometrie der Tibia und die Form des gebildeten Kallus variieren von Tier zu Tier. Mit Hilfe der Simulation lassen sich jedoch Materialkennwerte für die verschiedenen Heilungsstadien ermitteln. Auf diese Weise werden die Ergebnisse von der Geometrie weitestgehend unabhängig. Eine Vereinfachung ist, dass zunächst nur ein isotropes Materialverhalten angenommen wird. Bei der Problematik der Ermittlung von brauchbaren Materialkennwerten ist der hierdurch entstandene Fehler jedoch zunächst zu vernachlässigen.
Zusammenfassung
Die vorgestellte Methode ermöglicht es, Materialkennwerte für Kallus in Abhängigkeit des Heilungsstadiums zu ermitteln. Da die Einflüsse der speziellen Geometrien in die durchgeführten Finite- Elemente-Simulationen eingehen, können die so ermittelten von der Geometrie unabhängigen Materialkennzahlen für spätere Simulationen verwendet werden.
Referenzen
[1] Besdo, S.; Hackenbroich, Ch.; Richter, Α.; Thörey, F.; Besdo, D.; Widhagen, H.;Meyer-Lindenberg, Α.: In vivo measurement of the bending stiffness of rabbit tibiae during fracture healing. Biomed tech 50, Supplement 1/Teil2 (2005), S. 818-819
Finite Elemente Simulation der 4-Punkt-Biege- Versuche
Aus den Bilddaten des microCTs werden Finite- Elemente-Modelle für die osteotomierten Knochen generiert. Für die Simulation werden für den Knochen Materialkennwerte angenommen, wie sie in der Literatur zu finden sind. Die Materialkennwerte des Kallus werden variiert, wobei hierbei angenommen wird, dass ein isotropes Materialverhalten vorläge. Die Ergebnisse der Simulation werden mit den Messergebnissen der in vivo Versuche verglichen.
Daraus lässt sich ermitteln, welcher Elastizitätsmodul zu welchem Zeitpunkt der Heilung vorliegt.
92
B l O m a t e r i a l i e n 9 (3/4), 2008V O R T R A G E !
F. Uhl, R. Detsch, M. Schumacher, U. Deisinger, G. Zicglcr
ABSTRACTS
Vortrag 004
Bone Tissue Engineering mit biphasischen über Rapid Prototyping hergestellten Calciumphosphat-Scaffolds
Einleitung
Hydroxylapatit (HA) und Tricalciumphosphat (TCP) werden aufgrund ihrer chemischen Ähnlichkeit zum natürlichen Knochen häufig als synthetisches Knochenersatzmaterial eingesetzt. Die Rapid Prototyping (RP)- Technologie bietet hierbei eine schnelle Methode zur Herstellung individuell maßgeschneiderter Scaffolds. Eine innovative Therapieform mit enormem Potential zur Regeneration von Knochengewebe ist das Bone Tissue Engineering (BTE), welches Materialwissenschaft (Scaffolds) und Biologie (Zellkultur) kombiniert. In der vorliegenden Studie wurden daher Calciumphosphat-Scaffolds unterschiedlicher Phasenzusammensetzung mittels eines indirekten RP-Verfahrens hergestellt, mit murinen Knochenmarkzellen besiedelt und im Bioreaktor unter osteogener Stimulierung kultiviert, um deren Eignung für das BTE zu ermitteln.
60/40-Scaffolds vergleichbar, auf den TCP-Scaffolds hingegen signifikant niedriger.
Diskussion
Durch die Kultivierung im Bioreaktor wurden die Zellen auch im Inneren der Scaffolds gut versorgt, was zu einer durchwegs homogenen Besiedelung führte.
Eine osteoblastäre Differenzierung der Zellen lies sich auf allen Scaffolds nachweisen, war auf den TCP- Scaffolds jedoch verlangsamt. Diese Unterschiede lassen sich auf die stark osteokonduktiven Eigenschaften des HA zurückführen. Bei reinem HA und HA-reichen Scaffolds erfolgte eine schnellere osteoblastäre Differenzierung als bei TCP. Alle getesteten Phasenzusammensetzungen der hergestellten Scaffolds eignen sich dennoch für das BTE wobei die Mischkeramik (60/40) aufgrund der erhöhten Zellvitalität zu bevorzugen ist.
Material und Methoden
Die Scaffolds wurden über ein indirektes RP-Verfahren (negative-mould-Technik [1]) mit unterschiedlicher Phasenzusammensetzung (HA, TCP und HA/TCP 60/40 Gew.-%) hergestellt. Die Porendurchmesser betrugen ca. 300 μηι, die Stegdurchmesser ca. 500 μπι.
Murine Knochenmarkzellen (ST-2) wurden in RPMI 1640 mit FKS und Antibiotikum kultiviert. Zur osteogenen Stimulierung dienten Ascorbinsäure, Dexamethason und ß-Glycerolphosphat. Die beimpften Scaffolds wurden für 3 Tage statisch und anschließend 14 Tage dynamisch (im Bioreaktor) kultiviert. Zur Auswertung wurden biochemische Untersuchungen,
der molekularbiologische Nachweis osteoblastenspezifischer Marker mittels reverse-
transkriptase PCR (RT-PCR) und mikroskopische Analysen durchgeführt.
Literatur
[1] R. Detsch, F. Uhl, U. Deisinger, G. Ziegler: 3D- Cultivation of bone marrow stromal cells on hydroxyapatite scaffolds fabricated by dispense- plotting and negative mould technique. J Mater Sei:
Mater Med 19 (2008) 1491-1496.
Ergebnisse
Alle Scaffolds waren mechanisch ausreichend stabil und gut handhabbar. Nach 17 Tagen waren die Scaffolds homogen besiedelt und die Zellen wiesen überwiegend eine osteoblastäre, kuboidale Form mit starker Membranstrukturierung auf. Die positive osteoblastäre Differenzierung konnte durch die RT- PCR bestätigt werden. Auf allen Scaffolds war die Zellzahl vergleichbar. Die höchste Zellvitalität wiesen die Zellen auf den 60/40-Scaffolds auf, die geringste auf den TCP-Scaffolds. Die spezifische ALP-Aktivität sowie der Kollagen I-Gehalt war auf den HA- und
Ο Q BlOmaterialien 9 (3/4), 2008
ABSTRACTS
' V O R T R A G E
S. Schlüfter, R. Detsch, U. Deisinger, G. Ziegler
Vortrag 005
Vergleich der Resorption auf 2D- und 3D- Calciumphosphatproben durch osteoklasten- ähnliche Zellen
Einleitung
Synthetische Keramiken auf Calciumphosphatbasis (CaP) werden häufig als temporärer Knochenersatz verwendet. Dieser soll nach einer angemessenen Zeit abgebaut und durch körpereigenen Knochen ersetzt werden. Zur Untersuchung des Resorptionsverhaltens wurden osteoklasten-ähnliche Zellen auf 2D- und 3D- Proben aus HA (Hydroxylapaptit), TCP (Tricalciumphosphat) und einer Mischung aus HA/TCP von 60/40 (Gew.-%) kultiviert und die Zellentwicklung und -aktivität verglichen.
Material und Methoden
Sowohl die 2D- als auch die 3D-Konstrukte aus HA, 60/40 und TCP wurden aus kommerziell erhältlichem Pulver hergestellt. Die 2D-Proben wurden über uniaxiales Pressen gefertigt. Zur Herstellung der 3D- Konstrukte wurde sprühgetrocknetes Granulat verwendet. Mit diesem Granulat wurden mittels eines 3D-Druckers Scaffolds gefertigt (Forschungszentrum caesar, Bonn). Alle Proben wurden bei 1300 °C gesintert.
Für die Untersuchung des Degradationsverhaltens (chemische Löslichkeit) wurden die Proben in einer physiologischen, gepufferten Lösung entsprechend der Zellkultivierung 14 bzw. 21 d ausgelagert.
Anschließend wurde die Calciumionenkonzentration in der Lösung als Maß für die Degradation bestimmt.
Die 2D- und 3D-Konstrukte wurden mit stimulierten RAW-Zellen 14 bzw. 21 d inkubiert. Nach dieser Inkubationszeit wurden die Mitochondrienaktivität bestimmt, sowie verschiedene mikroskopische Analysen zur Charakterisierung der Zellentwicklung und -aktivität durchgeführt. Die Expression spezifischer Zellmarker wurde mittels RT-PCR überprüft.
60/40 resorbieren, auf den 3D-Proben nur die 60/40- Mischung. Diese Untersuchungen dokumentieren erstmalig die osteoklastäre in vitro Resorption von Keramikscaffolds mit einer granulären Struktur. Auf TCP waren weder auf den 2D- noch den 3D-Proben Lakunen zu finden.
Diskussion
Die Untersuchungen zeigen deutlich, dass die Übertragbarkeit der Ergebnisse einer 2D- auf eine 3D- Kultur nur bedingt möglich ist. Auf allen drei CaP- Phasen fand sowohl auf den 2D- als auch auf den 3D- Konstrukten eine Zellentwicklung statt. Die Aktivität der Zellen, die durch die Lakunenbildung gekennzeichnet ist, war auf den 2D-Proben auf HA und 60/40, auf den 3D-Konstrukten jedoch nur auf 60/40 nachweisbar. Neben der Phasenzusammensetzung scheint auch die Struktur (2D zu 3D) der Scaffolds einen großen Einfluss zu haben.
Literatur
[1] R. Detsch, H. Mayr, G. Ziegler: Formation of osteoclast-like cells on HA and TCP ceramics, Acta Biomaterialia 4 (2008) 139-148.
Ergebnisse
Die Analyse der Mitochondrienaktivität zeigte sowohl auf 2D- als auch auf 3D-Konstrukten keine signifikanten Niveauunterschiede zwischen den drei CaP-Phasen. Die TRAP-Färbung verdeutlichte die Entwicklung von TRAP-positiven Zellen auf allen Proben. Diese Ergebnisse wurden auch durch die RT- PCR-Analyse bestätigt. Anhand von REM-Aufnahmen wurde die Morphologie der Zellen beurteilt. Die Zellen entwickelten sich sowohl auf 2D- als auch auf 3D- Konstrukten auf HA besser als auf TCP [1].
Resorptionsuntersuchungen zeigten, dass stimulierte Zellen auf 2D-Proben nur die CaP-Keramiken HA und
BlOmaterialien 9 (3/4), 2008
V O R T R A G E ! ABSTRACTS
A.S. Spiro, Τ.F. Beil, M. Amling, J.M. Rueger
Vortrag 006
Experimentelle Untersuchungen zum Einfluß von Diclofenac auf die BMP-7 induzierte Knochenneubildung
Fragestellung
Diclofenac und andere Nichtsteroidale Antirheumatica (NSAR) sind als Standardtherapeutika im Rahmen der unfallchirurgisch/orthopädischen Behandlung etabliert.
In mehreren Studien konnte allerdings gezeigt werden, dass Diclofenac die Frakturheilung hemmt, indem es die Knochenneubildung inhibiert. Für die Knochenneubildung spielt die Ausschüttung der osteoinduktiven Bone Morphogenese Proteins (BMPs) insbesondere BMP-2 und BMP-7 eine herausragende Rolle. Ob Diclofenac einen Einfluß auf die BMP- induzierte Knochenneubildung hat, ist bisher nicht bekannt.
Schlussfolgerung
Diclofenac hat einen hemmenden Einfluß auf die BMP-7 induzierte Knochenneubildung im Mausmodell. Diese Ergebnisse legen einen besonnenen Einsatz von NSAR bei der Frakturheilung und bei der sehr kostenintensiven Behandlung mit rekombinanten BMPs nahe.
Methoden
21 weibliche Mäuse wurden in drei Gruppen eingeteilt und derselben Operation unterzogen. Bei der 1. Gruppe wurde ein Arzneimitteltäger mit 5 μg BMP-7 in die dorsale Oberschenkelmuskulatur implantiert, die 2.
Gruppe erhielt zusätzlich über den gesamten postoperativen Verlauf Diclofenac in einer humanen Äquivalenzdosis. Der 3. Gruppe wurde als Negativ- Kontrolle lediglich der Arzneimittelträger implantiert.
Am 10., 15. und 20. postoperativen Tag erfolgte die kontaktradiographische Untersuchung der Knochenneubildung. Am 20. postoperativen Tag wurde die Knochenneubildung zudem mittels mikroCT- Analyse, histologisch und histomorphometrisch ausgewertet.
Ergebnisse
Bei allen mit BMP-7 behandelten Mäusen konnte kontaktradiographisch eine ektope Ossifikation nachgewiesen werden. Die Quantifizierung dieser Ossifikation im mikroCT ergab eine signifikant reduzierte Knochenmasse in der Diclofenac-Gruppe (BV/TV: 4,99±2,91 vs. 9,51±1,71 %; p<0,05).
Histologisch zeigte sich eine signifikant verminderte Trabekelzahl in der Diclofenac-Gruppe (TbN:
1,38±0,57 % vs. 2,98±1,44 1/mm; p<0,05). In der Kontrollgruppe ohne BMP-7 kam es zu keiner ektopen Knochenbildung.
BlOmaterialien 9 (3/4), 2008
ABSTRACTS
V O R T R A G E
P. Mueller, J. Schöne, Ν. Ehlert, P. Behrens, S. Leschner, S. Weiss, M. Stieve
Vortrag 007
Imaging of Bacterial Infections Associated with Nanoporous Coated Implants in a Murine Model
Introduction
Highly biocompatible bioglass-ceramics are preferred as bone-replacement materials for applications in non- load bearing locations. However, it is of interest to control the biological interactions for specific purposes, in particular the prevention of microbial biofilm formation on native material surfaces shortly after implantation. Once established, such biofilms are highly resistant to conventional antibiotic treatments.
To modify specific implant-tissue interactions nanoporous silica surface coatings were applied to Bioverit0 II samples (1,2), as native and coated implants may interact differently with microbes and host tissue. To investigate the in vivo interactions of nanoporous coated bioglass-ceramic implants with biofilm-forming bacteria, Salmonella typhimurium bacteria were used that were genetically labeled with constitutively expressed luciferase.
Materials and Methods
l x l mm Bioverit0 II cylinders were coated with a nanoporous silica layer according to published procedures (1). The coated and plain Bioverit samples, respectively, were incubated in a suspension of 2 x l 07
S. typhimurium colony forming units in PBS for 15 min. and directly implanted subcutaneously into Balb/c mice (Harlan-Winkelmann). The mice were raised under specific pathogen-free conditions. The Salmonella carried the complete lux operon (lux CDABE) derived from the enterobacterium Photorhabdus luminescens.
The implant-associated bacterial luminescence was monitored in an IVIS-200 Optical In Vivo Imaging System (Xenogen).
Results
To establish a test system for nano-porous implant coatings and their efficacy as a carrier for antimicrobial drug delivery genetically labeled Salmonella were used as a model for biofilm-forming microbes. Two different labeling techniques were used, either a chromosomally integrated copy of a luciferase gene or an extra-chromosomal copy on a plasmid. The implants were coated in a bacterial suspension shortly before subcuta-neous implantation. The mice survived and remained active throughout the entire experiment. The bacterial luciferase activity from the mice carrying the implants was monitored in an IVIS imager. N o signal was detected with implants in the absence of bacteria.
At least a major fraction of the bacteria apparently remained locally concentrated with the implant during the course of this experiment. Whereas the initial light
emission from the plasmid encoded luciferase was higher, the bioluminescence rapidly decreases such that after one week it could no longer be detected (see Figure 1). In contrast, the bacteria with the chromosomally integrated luciferase construct remained visible throughout the observation time.
Discussion
We have established a live imaging system to monitor implant associated bacteria. A luciferase gene stably integrated in the Salmonella chromosome appears suitable as a model system to detect bacterial survival or death on modified implant surfaces. The approach is a first step to investigate antimicrobials on nanoporous implant coatings.
Acknowledgements
This study was carried out within the Collaborative Research Area SFB599 (TP D l ) .
References
(1) C. Turck, G. Brandes, I. Krueger, P. Behrens, Th.
Lenarz, M. Stieve. Acta Oto-Laryngol. 127 (2007) 801- 808.
(2) J.C. Vogt, G. Brandes, I. Krüger, P. Behrens, I.
Nolte, Th. Lenarz, M. Stieve. J Mater Sei Mater Med 19 (2008) 2629-36.
Fig. 1: In vivo monitoring of implant-associated Salmonella typhimurium. Nano-porous coated Bioverit implants were covered with bacteria labeled with either chromosomally integrated luciferase (left) or plasmid- encoded luciferase (right). The bacterial light emission from the chromosomal luciferase copy is detectable for up to one week after implantation with the IVIS imaging system(see spot below the ear), whereas the plasmidal copy not detectable after this time.
Q f o B l O m a t e r i a l i e n 9 (3/4), 2008
ABSTRACTS VORTRAGE
Μ. Thomann, Τ. Hassel, D. Bormann, Ν. von der Höh, A. Krause, H. Windhagen, A. Meyer-Lindenberg
Vortrag 008
Einfluss einer Magnesiumfluoridbeschichtung auf die Degradation von MgCaO,8-ImpIantaten in vivo
Einführung
Die Magnesiumlegierung MgCa 0,8 scheint grundsätzlich für den Einsatz als resorbier-bares Osteosynthesematerial geeignet zu sein [1], In vivo- Untersuchungen zeigten jedoch bereits nach dreimonatiger Implantations-dauer eine deutliche Korrosion [2], In der Literatur wurde berichtet, dass die Be-schichtung von Magnesiumlegierungen in vitro zu einer verringerten Degradationsgeschwindigkeit führt
[3].
In der vorliegenden Studie sollte überprüft werden, ob eine MgF2-Beschichtung in vivo einen Einfluss auf die Degradationsge-schwindigkeit der MgCa0,8- Implantate hat.
Material und Methoden
Bei den Implantaten handelte es sich um stranggepresste MgCa0,8-Pins (25 χ 2,5 mm). 20 Implantate wurden durch ein Bad in 40%iger Flusssäure mit einer MgF2-Schicht versehen, weitere 20 Pins blieben unbeschichtet. Nach Sterilisation wurden sie intramedullär in beide Tibiae von New Zealand White-Kaninchen implantiert. Die Explantation der Tibiae für die weiteren Untersuchungen fand nach drei bzw. sechs Monaten statt. Die rechten Tibiae wurden im Implantat- Knochen-Verbund im μ-Computertomographen (μϋΤ80, Fa. Scanco Medical) gescannt. Die Implantate der linken Tibiae wurden entnommen und raster- elektronenmikroskopisch untersucht. Zur Bestimmung des Degradationsgrades erfolgten Volumen- bestimmungen der entnommenen Implantate.
Ergebnisse
Sowohl μ-CT-, als auch REM-Untersuchungen zeigten bei allen Gruppen eine ähnliche Implantatmorphologie (Abb.l). Bei beschichteten und unbeschichteten Pins war Lochfraßkorrosion erkennbar (Abb.2), die mit ansteigender Implantationsdauer verstärkt auftrat. Im Verlauf zeigten alle Pins eine Abnahme des Volumens.
Während bei der Volumenbestimmung nach drei Monaten kein deutlicher Unterschied zwischen beschichteten und unbeschichteten Implantaten nachgewiesen werden konnte, besaßen die beschichteten Implantate nach sechsmonatiger Implantationsdauer ein um ca. 13 % größeres Volumen als die unbeschichteten.
Diskussion
Die MgF2-Schicht konnte eine Lochfraßkorrosion nicht verhindern. Erklärbar ist dies möglicherweise mit dem nicht vollständig schädigungsfreien Habitus der
Schicht. Mikrorisse und Poren stellen Angriffspunkte für die Korrosion dar, da hier Elektrolyte der Körperflüssigkeit am Basismetall angreifen können.
Trotzdem bewirkte die Beschichtung mit MgF2 auch in vivo eine Verlangsamung der Degradation der Magnesiumimplantate.
Fig. 1: REM-Aufnahmen der MgCa0,8-Implantate;a=
beschichtet, vor Implantation; b = unbeschichtet; c = beschichtet, jeweils nach dreimonatiger Implantationsdauer (Balken=lmm).
Fig. 2: μ-computertomographische Aufnahmen der Implantate in der Tibiamarkhöhle nach sechsmonatiger Implantationsdauer; a = unbeschichtet; b = beschichtet (Balken=lmm).
Danksagung
Diese Studie ist Teil des durch die DFG geforderten SFB599
Literatur
[1] Krause, A. (2008): Untersuchung der Degradation und Biokompatibilität von degradablen, intramedullären Implantaten auf Magnesiumbasis, Diss., Hannover.
[2] von der Höh, N. (2008); Einfluss der Oberflächenbearbeitung von resorbierbaren Knochenimplantaten aus Magnesium-Calcium- Legierungen auf das Degradationsverhalten im Kaninchenmodell
[3] Bach, F-W. et al. (2005):Corrosion Protection and Repassivation after the Deformation of Magnesium Alloys Coated with a Protective Magnesium Flouride Layer, Magnesium Technology, California, 485^191.
Q ~y BlOmaterialien 9 (3/4), 2008
ABSTRACTS
Vortrag 009
V O R T R A G E
D. Bozukova, C. Pagnoulle, M.-C. De Pauw-Jillet, D. Klee, R. Jeröme, C. Leröme
Intraocular lens surface modification toward resistivity to posterior capsular opacification
Introduction
Cataract is a common and important cause of loss of vision world-wide. Nowadays, cataract surgery is the most frequently performed well-established ophthalmologic procedure that involves the extraction of the natural opacified lens crystalline by capsulorhesis and the IntraOcular Lens (IOL) implantation. Posterior Capsular Opacification (PCO) is a main complication that appears in about 30-50% of the cases after the surgical intervention as a result of proteins adsorption and lens epithelial cells (LECs) adhesion. Neodynium: YAG (Nd:YAG) laser capsulotomy is the only practical way to treat PCO, not without complications (possible retinal detachment, damage to the IOL, increase in the intraocular pressure, etc). The latter is a procedure with serious financial cost. Therefore, efficient prevention of PCO formation would be privileged rather than treatment. Formation of antifouling coatings on the IOL surface would lead to diminution of the proteins adsorption and cells adhesion, thus resulting in PCO prevention. Very hydrophilic or very hydrophobic coatings, such as poly(ethylene glycol) (PEG) and fluorinated ones, respectively, are well known for their antifouling properties.
Materials and Methods
The surface of poly(2-hydroxy ethyl methacrylate- co- methyl methacrylate) IOL hydrogels (BenzFlex, equilibrium water content of 26 %) was modified. The grafting polymers, PEGs and fluorinated polymers, were supplied by Aldrich. The coatings were characterized by Attenuated Total Reflectance Fourier Transform Infrared Spectroscopy, Scanning Electron microscopy (SEM), Environmental SEM, Atomic Force microscopy, and Contact angle of water and air.
The coatings biofouling resistivity has been evaluated by protein adsorption and cell adhesion in vitro tests with Green Fluorescent Protein and ß-lactamase, and porcine crystalline LECs, respectively.
Results and Discussion
Hydrophilic PEG- and hydrophobic fluorinated- coatings have been created on the IOLs surface (i) either by Radiofrequency and Microwave plasma enhanced deposition of the respective gasses, or (ii) by standard chemical modification. The chemical modification methods are generally devided in
« grafting from » and « grafting onto » methods, that lead to the formation of brush- and linear- polymer coatings, respectively. The brush- coatings strongly affected the surface topography, leading to irreversible
roughing, whereas the linear-ones preserved the low rugosity of the surface compared to the initial substrate.
The coatings wettability and stability were found to depend strongly on the technique implied in the modification process. Hence, the chemically grafted coatings demonstrated greater stability compared to the plasma created ones.
Meanwhile, the linear- PEG and the chemical fluorinated coatings were found to impart the surface with the most pronounced anti- fouling properties, whilst preserving the optical performances of the initial substrate.
References
(1) D. Bozukova; C. Pagnoulle; M.C. De Pauw- Gillet; S. Desbief; R. Lazzaroni; N. Ruth; R. Jerome;
C. Jerome. Improved Performances of Intraocular Lenses by Polyethylene glycol) Chemical Coatings.
Biomacromolecules (2007) 8, 2379
(2) D. Bozukova; C. Pagnoulle; M.C. De Pauw- Gillet; N. Ruth; R. Jerome; C. Jerome. Imparting Antifouling Properties of Poly(2-hydroxyethyl methacrylate) Hydrogels by Grafting Poly(oligoethylene glycol methyl ether acrylate) Langmuir (2008), 24(13); 6649
Fig. 1
φ g B l O m a t e n a ü e n 9 (3/4), 2008
VORTRAGE! ABSTRACTS
J. Fischer, Μ. Wolff, Τ. Ebel, R. Willumeit, F. Feyerabend
Vortrag 010
Towards producing biodegradable magnesium implants by powder Metal Injection Moulding
( M I M ) Introduction
Aside from its well established use in lightweight construction, magnesium (Mg) is highly suitable as a future material for medical applications such as biocompatible and biodegradable implants. M g degrades completely, has an Ε-modulus similar to bone, is osteoconductive and an essentially needed element for the human body - a promising candidate as implant material for orthopedic application. Metal Injection Moulding ( M I M ) possesses a high potential for the production of implants with a complex structure. However, sintering of M g powder is strongly inhibited by the stable oxide layer which is formed immediately after exposure to air. In this study, different magnesium-based powder blends were investigated to overcome this problem. By adding calcium (Ca) and lithium (Li), the protection of M g against additional oxygen during processing and the reduction of already existing oxide layers was achieved.
Material and Methods
For the sintering experiments, specimens with two different compositions were blended: M g C a l and M g L i l . For this the pure M g p o w d e r was blended with calcium and lithium hydrides (CaH2, LiH) and in a second route, with Mg-Ca master alloy powders (MAPs) (MgCa6.9, C a M g l 8 ) to initiate solid phase sintering via a temporary liquid phase. The M A P s have a lower melting point than M g and the idea was that the melting MAPs sticks the M g together before the actual sintering process.
T h e entire sample handling took place under argon. To avoid agglomeration, moisture- and oxygen free cyclohexane was used as milling agent. Cylindrical specimens with 8 m m diameter were manufactured by double sided, uniaxial pressing at surface pressure of 100 MPa in a manual mode press. The compositions allowed a heat treatment up to 605 °C without formation of a liquid phase. The specimens were heat treated in a hot wall furnace under Ar 6.0 (purity = 99.9999 Vol%). The specimens were then analysed with REM and a stress test. The shrinkage of the samples was measured and the residual porosity calculated.
h, respectively. Only sparse sintering necks could be found. The samples had no stability after sintering.
Ca Hi hardly improved the sintering and lead to large pores. The addition of LiH supported the sintering decisively. The best results were obtained by using M A P s . Excellent sintering with a good rest porosity was observed and the stress test showed remarkable results (Rm = 250 MPa for the M A P samples measured with a pressing test).
Discussion
T h e sintering of Mg could definitely be enhanced by adding small amounts of LiH and M A P s . Great attention has to be paid to a pure and oxygen-free atmosphere during sintering. With respect to the prospective MIM of M g and the inherent thermal debinding process under vacuum, the blending of the M g powder with the M A P C a M g l 8 is advantageous, because of the low melting point of 445 °C. At this temperature, the melted eutectic alloy j o i n s the Mg powder, while the vapour pressure of Mg is still low enough to avoid substantial mass loss.
Results
Pure M g hardly sintered at all, even if temperature and duration were gradually increased up to 630 °C and 64
Ρ φ B l O m a t e r i a l i e n 9 (3/4), 2008
ABSTRACTS
"VORTRAGE
K.-H. Heffels, P. Gasteier, D. Grafahrend, J. Salber, Μ. Möller, J. Groll
Vortrag Oil
An easy route to biofunctional electrospun fibres with reactive star shaped PEO-stat-PPO based molecules for tissue engineering
Though the interest in electrospun fibers increased dramatically during the last decade, functionalization with biological active molecules remains challenging.
Especially for biomedical applications like tissue engineering, minimization of unspecific protein adsorption is a key step in controlling the interactions of the fibers with the host environment. While linear or star shaped poly(ethylene oxide) (PEO) is commonly used to avoid unspecific protein adsorption[l], polyesters like poly(lactide-co-glycolid) enable the production of bioresorbable materials.
We present a method for the preparation of degradable fibres comprised of NCO sP(EO-staf-PO) crosslinked poly (lactide-co-glycolid) that do not unspecifically interact with proteins and cells but can be decorated with biofunctional moieties at their surface.
Materials and Methods
Resomer RG 504 Η was donated by Boehringer Ingelheim (Germany). Rhodamine red labeled bovine serum albumine (BSA) was purchased from Molecular Probes (Germany) and GRGDS were supplied by Bachem (Switzerland). Isocyanate terminated six arm star poly(ethylene oxide-stoi-propylcnc oxide) with 80% ethylene oxide content (NCO sP(EO-staf-PO)) was prepared as described previously[l]. To achieve functionalized fibres, NCO sP(EO-stai-PO) (Mw = 12 kDa or 18 kDa) was co-electrospun with PLGA (Mw = 65kDa). The fibres were collected for 50 s in a 200 mm distance from the tip of the spinneret. A voltage of 25 KV was applied to the polymer solution with a Series 205B high voltage power supply (Bertan, NY, USA).
Degradation studies were carried out by incubating samples (70 mg) of the non-woven with PBS buffer solution under physiological conditions over 60 days.
not become adherent on the NCO sP(EO-stai-PO) modified fibres after 24 hours of cell culture. In contrast, after immobilization of the cell adhesion mediating peptide sequence GRGDS on the fibre surface, strong cell adhesion occurs on the fibres resulting in well spread cell morphologies. Life-dead staining confirmed vitality of the cells.
Conclusion
An easy one-step preparation method for biofunctional electrospun non-woven fibres was developed and exemplarily demonstrated using the peptide sequence GRGDS. The functionalization method is not restricted to GRGDS only, but can be extended to any molecule with at least one hydroxyl or amino group.
References
[1] Gasteier, P., Reska, Α., Schulte, P., Offenhäusser, Α., Moeller, Μ., Groll, J., Macromol. Biosci., 7, 1010, 2007.
Acknowledgments
This work was supported by the DFG Graduiertenkolleg 1035 "Biointerface".
Results and Discussion
While pure PLGA fibres induce unspecific adsorption of proteins, the addition of only 5 wt% NCO sP(EO- stat- PO) prior to electrospinning drastically hydrophilizes the fibre surface and minimizes unspecific protein adsorption. Polydispersity of NCO sP(EO-siai-PO)-co-PLGA samples was significantly higher than those of pure PLGA fibers, indicating the cross-linking between the two polymers. Degradation of the electrospun fibers was dramatically altered by the hydrophilic NCO sP(EO-?to/-PO) resulting in accelerated mass loss and increased chain scissions. In cell culture experiments, human dermal fibroblasts did
1 0 0 B I O m a t e r i a l l e n 9 (3/4), 2008
VORTRAGE" ABSTRACTS
J. Hauser, S. Bensch, Η. Halfmann, P. Awakowicz, H.-U. Steinau, S. Esenwein
Vortrag 012
Plasmagestützte Kollagen-Beschichtung von Implantatmaterialien zur Erhöhung der Biokompatibilität
Einleitung
Die schlechte Biokompatibilität vieler medizinischer Implantatmaterialien stellt nach wie vor ein großes Problem dar. Schon seit geraumer Zeit werden Versuche unternommen die Bioverträglichkeit von Fremdmaterialien durch eine Beschichtung mit zelladhäsiven Substanzen zu verbessern. Die Beschichtung von Implantatmaterialien wie z.B.
Metalle und insbesondere Kunststoffe, ist allerdings oft äußerst schwierig.
Dies ist in den Materialeigenschaften der Implantate begründet. Eine mögliche Lösung könnte hier durch den Einsatz von Niederdruckplasmen erreicht werden.
Durch diese Plasmatechnik können insbesondere empfindliche Oberflächen modifiziert und veredelt werden. Man spricht hier von einer so genannten Oberflächenaktivierung. Die primäre Wechselwirkung von Biomaterialien im Kontakt mit flüssigen biologischen Medien besteht in der Adsorption von Proteinen. Die Adsorption wird dabei von den physikalischen und chemischen Eigenschaften der Materialoberfläche bestimmt. Mit zunehmender Hydrophilie und erhöhter Oberflächenenergie erhöht sich die Adsorption von Proteinen auf der Materialoberfläche. In dieser experimentellen Studie haben wir den Versuch unternommen Silikon-und Metallproben mit bioaktiven Molekülen zu beschichten und hinsichtlich des Anwachsverhaltens sowie der Proliferationsrate humaner Zellen untersucht.
Implantatoberflächen erfolgte durch eine Calcein-AM Färbung. Die Proliferation der Zellen wurde mit EZ4U- Kit gemessen.
Ergebnisse
Die Versuche der Kollagen I Beschichtung ergaben, dass lediglich auf den plasmabehandelten Implantatmaterialien eine adhärente, homogene Kollagenbeschichtung aufgebracht werden konnte. Bei den nicht plamabehandelten Oberflächen war die Kollagenschicht nicht haltbar und wurde durch das Abspülen mit PBS-Puffer nahezu vollständig von der Oberfläche abgewaschen. Bei der Analyse der Proliferationsrate der Zellen zeigte sich, dass die Proliferation der Zellen auf den kollagenbeschichteten Prüfkörpern um 4 0 % höher war als auf den nicht beschichteten. Bei der Auswertung der Calcein-AM Färbung konnte nachgewiesen werden, dass die Anzahl von vitalen und adhärenten Zellen auf den kollagen- beschichteten Materialien signifikant erhöht war.
Schlussfolgerung
Die Behandlung von Silkon und Titanprüfkörpern mit Niederdruckplasma ermöglicht eine schonende Beschichtung der Implantatmaterialen und erhöht somit die Biokompatibilität in vitro.
Methodik
Es wurden 4 Implantatmaterialien verwendet (Ti6A14V, TiöAlNb, X 2 C r N i M o l 8 und Silikon).
Plasmabehandlung: Die Prüfkörper wurden in einem doppelt induktiv gekoppeltem Plamareaktor plasmabehandelt.
Kollagenbeschichtung: Nach der Plasmabehandlung wurden die Proben mit Kollagen Typ I beschichtet.
Nach einer 30 min. Antrocknungsphase wurde das nicht adhärente Kollagen mittels PBS Puffer abgespült.
Danach wurden die Proben mittels Fuchsinrot gefärbt und anschließend erneut mit destilliertem Wasser abgespült. Nicht plasmabehandelte Prüfkörper dienten als Kontrolle.
Proliferations-und Zelladhäsionsanalyse: Zur Analyse der Zellproliferation und der Zelladhäsion wurden auf den kollagenbeschichteten Prüfkörpern osteoblastäre SAOS-2 Zellen kultiviert. Die Zellen wurden auf dem Untersuchungsgut mittels Mikrofluorophotographie analysiert und durch eine quantitative Bildanalyse ausgewertet. Die Adhärenzanalyse der Zellen auf den
1 Q 1 BlOmaterialien 9 (3/4), 2008
ABSTRACTS
"VORTRAGE
Κ. Zurlindcn, Μ. Laub, Ε. Spassova, D. Moser, R. Ewers, H.P. Jennissen
Vortrag 013
RhBMP-2 loaded Microstructured Phycogenic bone substitutes
Introduction
In maxillofacial/orthopedic surgery application of autologous bone graft for defect filling due to trauma or cancer is a common procedure. However due to the limited availability of autologous bone the use of inorganic bone graft substitutes becomes widely accepted as these materials show good biocompatibility and osteoconductive properties [1]. In order to allow healing of larger defects and accelerate the healing of smaller defects enhanced bone growth has to be achieved. This is feasible by coating these materials with bone morphogenetic proteins like BMP-2. At present collagen sponges are clinically used as carrier for BMPs (InductOs, Ossigraft). However it has been shown that these materials bind only minor amounts of BMP-2 (8-80 μg/g collagen) [2] with half-lives in a range of 2-3 days [3]. We show here that rhBMP-2 can be immobilized in bioactive form on HA/TCP surfaces (Aigisorb, Algipore, Algoss GmbH) in an amount of up to 7 mg/g. The bound protein is slowly released from the surface with half-lives from 20 to 30 days. In vitro (alkaline phosphatase induction) and in vivo data (sheep gap healing model) will be presented which unambiguously prove the efficiency of this technique.
Materials and Methods
Algipore (98% HA, Algoss) was used as a hydroxyapatite-based (HA) and Aigisorb (80 % TCP, 20 % HA, Algoss) as HA/TCP based material. For hydrophobic binding of rhBMP-2 bone graft materials were reacted with 3-aminopropyltriethoxysilane (APS).
After incubation in rhBMP-2 solution (0.1-1.0 mg/ml) the amount of bound protein was determined by using
125I-rhBMP-2. [4] The bioassay for BMP-2 activity is based on the induction of alkaline phosphatase (ALP) in MC3T3-E1 cells by BMP-2.The resulting product form an intensely fluorescent yellow-green precipitate at the site of enzymatic activity.
Results
Incubation of Aigisorb (Fig.lA) reveals a linear relationship between the amount of bound protein and the rhBMP-2 concentration in incubation solution. Up to nearly 7 mg rhBMP-2/g granules can be bound.
As shown in Figure IB there is a two-phase exponential release of rhBMP-2 from the surface of Aigisorb. An initial release burst is followed by a prolonged second phase. The bound protein is released with half-lives in a range from 20 to 30 days. This makes rhBMP-2-coated Aigisorb to an optimal drug delivery system for bone growth. The biological
activity of rhBMP-2 immobilized on Aigisorb granules is shown in Figure 2 as determined by the de novo synthesis of alkaline phosphatase in MC3T3-E1 cells cultivated on the granules. The bound rhBMP-2 shows biological activity comparable to the positive control (soluble BMP-2).
Conclusions
I) RhBMP-2 can be immobilized in bioactive form on HA and HA/TCP surfaces (Algipore, Aigisorb, Algoss) in an amount of up to 7 mg rhBMP-2/g bone graft material.
II) Desorption kinetics reveal half-lives ranging from 20 to 30 days.
III) In vitro (alkaline phosphatase induction) and in vivo data (sheep gap healing) show unambiguously the efficiency of this technique.
References
[1] Ewers, R. (2005) J. Oral Maxillifac. Surg. 63, 1712-1723 [2] Laub, M„ Chatzinikolaidou, M.
Jennissen, H.P. (2007) Materialwiss. Werkstofftech. 38, 1020-1026 [3] Gao, T., Kousinioris, S.R., Winn, S.R., Wozney, J.M., Uludag, H. (2001) Materialwiss.
Werkstofftech. 32, 953-961 [4] Zurlinden, K„ Laub, M„ Jennissen H.P. (2005) Materialwiss. Werkstofftech.
36, 820-827
rhBMP-2-Solution Concentration [mg/ml]
Fig. 1:
A) Immobilization of rhBMP-2 on Aigisorb
1 0 2 B , 0 m a t e r i a ] i e n 9 ρ/4)·2008
VORTRAGE! ABSTRACTS
half-lives:
0.4 / 31.6 days 0.7 / 20.4 days
Time [d]
Fig. 1:
B) Release of rhBMP-2 from Aigisorb granules (c = 0.3 mg/ml)
hydrophobic Aigisorb + rhBM-2
hydrophilic Aigisorb + rhBMP-2
r
•>9positive control negative control
ι I Fig. 2:
Biological activity of rhBMP-2 immobilized on Aigisorb granules (c=0.1 mg/ml)
positive control: non-modified Aigisorb + soluble rhBMP-2
negative control: non-modified Aigisorb - rhBMP-2
"I Q 2 BlOmaterialien 9 (3/4), 2008
ABSTRACTS
VORTRAGE
Τ. Sänger, Μ. Lange, Μ. Laub, Η.Ρ. Jennissen
Vortrag 014
Foamed rhBMP2/Poly-(D,L)-Lactide as drug delivery system for bone tissue engineering
Introduction
We showed that it is possible to incorporate large ammounts of biological active rhBMP2 (3.4 mg/g PDLLA) into a PDLLA-matrix [1], by foaming PDLLA-powder with supercritical C 02 at 100 bar and 45° C [2],
Foamed rhBMP2/PDLLA tablets were analyzed, concerning the hydrolysis rate, release of incorporated rhBMP2 and influence of foaming with supercritical C 02 on the biological activity as well as the biological efficiency of rhBMP2.
Materials and Methods
RhBMP2 was prepared in Ε .coli and labeled with l25I according to the chloramine-T-method [4]. PDLLA- powder was sterilised by γ-irridation at 25 kGy and rhBMP2/PDLLA tablets were made as described [1], Hydrolysis of PDLLA was analyzed by using a model for accelerated aging of polymers [3] and size exclusion chromatografie (SEC) of freeze dried tablets.
Tablets loaded with 125l-rhBMP2, were incubated for different time spans (one hour up to 40 days) in PBS- buffer (pH 7.4) at 50° C to accelerate the hydrolysis rate.
The biological activity of rhBMP2 was tested with the osteoblast cell line, MC3T3-E1, by induction of alkaline phosphatase [4],
The biological efficiency of rhBMP2 was tested in the supernantant (pH 7.4 at 37°C) of released 125I-rhBMP2, at concentrations from 1 to 400 mM, with the osteoblast cell line, MC3T3-E1, by induction of alkaline phosphatase.
Results
Molecular weigth
In Fig.l it is shown, that within day 1-19, a rapid decrease in molecular weight from 103340 g/mol to 9340 g/mol occured. This accelerated decrease is due to γ-irridation of the PDLLA and increased incubation temperature of 50°C.
Decrease in Molecular weight in d e p e n d e n c e of incubation time at 50°C
time [d]
Fig. 1: Mw determined by rhBMP2/PDLLA-tablets with SEC.
Released rhBMP2
A burst phase from day 1 -3 occured where 4.9% of the incorporated rhBMP2 was released, followed by a slow phase, between day 3-19, where 3.1% rhBMP2 was released. Between day 19-40 the tablet began to disintigrate and a second burst phase occured, where 8.7% of rhBMP2 was released. The total released rhBMP2 was 16.8%. Analizing of the incubation vials in a γ-counter without buffer, revealed, that appr. 80%
of the rhBMP2 was still in the vials.
Biological activity
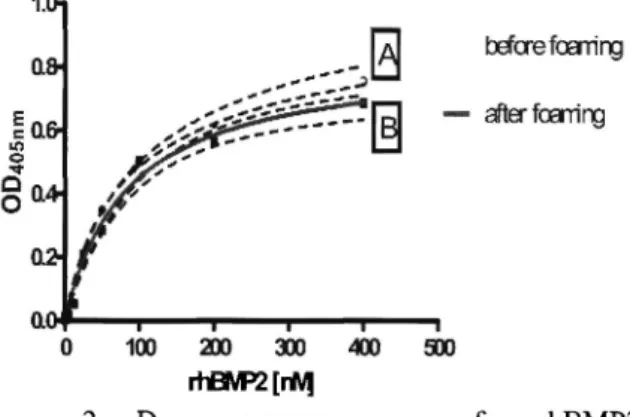
As shown in Fig.2, incorporated and foamed rhBMP2 is biological active. In Fig.3 it is demonstrated, that foaming has no significant influence on the biological efficiency.
r+f3VP2 [rW|
Figure 2: Dose response curves for rhBMP2 A: native rhBMP2 B: released rhBMP2
] 0 4 IB'Omaterialien 9 (3/4), 2008
ArNeg.Contr ol
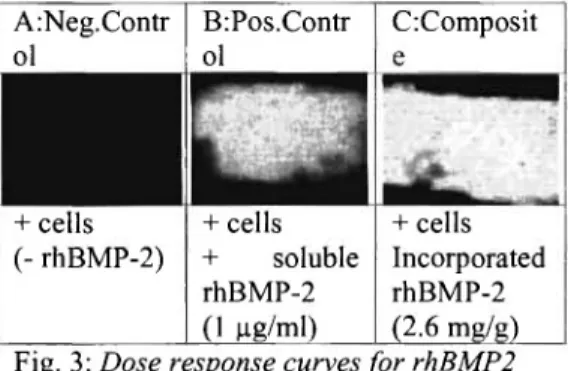
B:Pos.Contr ol
+ cells (- rhBMP-2)
C:Composit
+ cells
+ soluble rhBMP-2 (1 μΒ/ml)
+ cells Incorporated rhBMP-2 (2.6 mg/g)
VORTRAGE! ABSTRACTS
Fig. 3: Dose response curves for rhBMP2
Conclusions
I) Incorporated and released BMP2 is biological active II) Foaming has no significant influence on the biological efficiency of incorporated and released rhBMP2
References
[1] Lange, Μ., Sänger, Τ., Chatzinikolaidou, Μ., Laub, Μ. Jennissen, Η.P.
Abstr. Commun., 8th World Biomaterials Congress, 2008
[2] Tschakaloff A; von Oepen R; Seibt S; Vieting M;
Michaeli W; Dtsch Ζ Mund Kiefer GesichtsChir, 20, 47-50,1996
[3] ASTM-International, Standard Guide for Accelerated Aging of Sterile Medical Device Packages, Designation: F 1980-02
[4] Chatzinikolaidou, M; Zumbrink, T; Jennissen, Η.Ρ;
Materialwiss-Werkstofftch.; 34, 12, 1106-1112, 2003
1 0 5 |B' ®m a t e l i a l i e n 9 (3/4), 2008