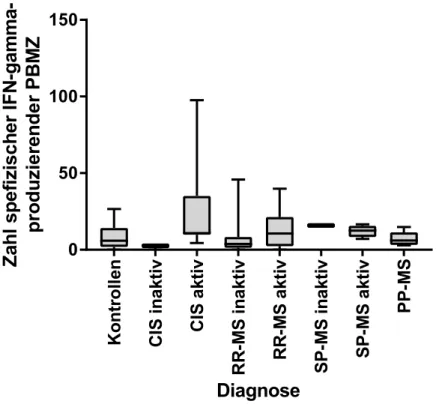
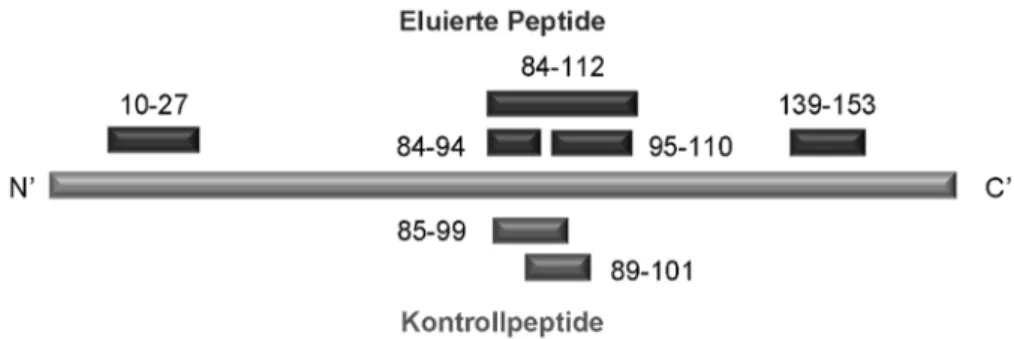
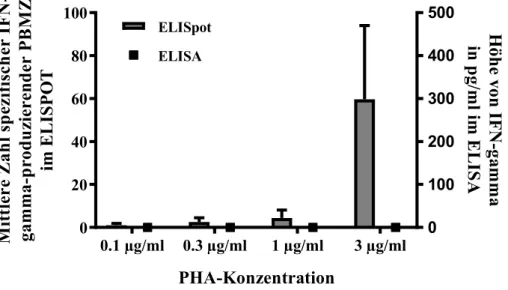
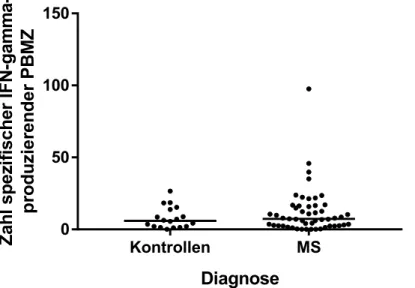
IMMUNREAKTIVITÄTEN GEGEN IM ZENTRALEN NERVENSYSTEM NATÜRLICH PRÄSENTIERTE PEPTIDE BEI PATIENTEN MIT MULTIPLER SKLEROSE
Volltext
Abbildung


ÄHNLICHE DOKUMENTE
Auf Grund von Hinweisen, dass bei der EAE von GR dim -Mäusen nach einer Dex- Therapie weniger Zellen im Rückenmark gefunden werden und dass weiterhin Dex
Ausgehend von der hier vorgestellten Hypothese, dass BACE1 für den Erhalt der Myelinscheiden notwendig ist, und der Rolle, die BACE1 bei der Myelinisierung spielt (Hu et al.
In a previous pilot study we reported the feasibility of visual perceptive computing (VPC) for gait assessment in PwMS using the Short Maximum Speed Walk (SMSW), which assesses gait
So konnten folgende Untersuchungen durchgeführt werden: Chemosensorisch evozierte olfaktorische Potenziale: n=21, orthonasale Riechfunktion (SDI-Wert): n=30, retronasale
Durch die Verwendung des CD11c-DTR-GFP-Modells in C57BL/6- Mäusen konnte in dieser Arbeit jedoch eine konditionelle Depletion dendritischer Zellen während
(1998) haben bei MS-Patienten signifikant höhere Antikörpertiter für GM1 und GM3 gefunden als bei Patienten mit anderen neurologischen Erkrankungen, jedoch haben sie nur
Um weitere Informationen über mögliche Zusammenhänge von Anellovirusinfektionen und MS zu erhalten, wurden in dieser Arbeit Serum- und Liquorproben von MS-Patienten
Zur symptomatischen Behandlung von MS-Beschwerden und Folgeerscheinungen zählen Medikamente bei Blasenstörung und Inkontinenz, gegen Spastiken, Fatigue, Depression und