Jahrestagung 2010 der DGBM
Prof. Dr. Klaus Liefeith
Prof. Dr.
Klaus Liefeith
Liebe Kolleginnen und Kollegen,
die Jahrestagung 2010 der Deutschen Gesellschaft für Biomaterialien wird im Jahr 2010 im schönen Eichsfeld unweit des Dreiländerecks Hessen-Thüringen-Niedersachsen statt- finden! Sie sind uns vom 18. bis zum 20. November 2010 in der Stadthalle der Kurstadt Heilbad Heiligenstadt sehr herzlich willkommen.
Wir haben uns entschieden, die diesjährige Jahrestagung unter dem Leitthema:
„Gewebeersatz/Geweberegeneration: Von der Grenzfläche zum Biointerface"
zu veranstalten.
Aufgrund der thematischen Breite dieses Leitthemas haben wir zwei Themenkomplexe ge- bildet, die wir gern gemeinsam diskutieren wollen:
A) Bioaktive Materialien für den Gewebeersatz und neue in vitro!in iwo-Teststrategien
• Biomaterialien im Kontakt mit dem Hartgewebe
• Biomaterialien im Kontakt mit dem Weichgewebe und Blut
• Biomaterialien im Kontakt mit Mikroorganismen/Biofilmen sowie
B) Bioaktive Materialien für die Geweberegeneration und neue bioreaktorbasierte Kultivierungsstrategien
• Biomaterialien für das Knochen-Tissue Engineering
• Biomaterialien für das Knorpel-Tissue Engineering
• Biomaterialien für das Gefäß-Tissue Engineering
Integrierende Komponente soll das Design und die Testung des Biointerface sein. Jedem Themenblock wird ein „State-of-the-Art" Vor- trag eines herausragenden Wissenschaftlers im jeweiligen Forschungsgebiet vorangestellt. Wir freuen uns sehr, dass es gelungen ist hier- für vor allem Kliniker aus den jeweiligen Fachgebieten zu gewinnen. Wie in vielen Bereichen der Life Sciences haben Grenzflächen- wechselwirkungen zwischen der belebten und unbelebten Natur, zwischen Biomolekülen, Mikroorganismen, Zellen und Geweben ein- erseits und biomedizinischen Materialien andererseits einen wesentlichen Einfluss auf den therapeutischen Erfolg von Implantaten im klinischen Alltag. Die gezielte Untersuchung und die Beeinflussung dieser Wechselwirkungen mit dem Ziel der Generierung eines bio- kompatiblen und biofunktionellcn Biointerfaces, z.B. in Analogie zur extrazellulären Gewebematrix, finden auf molekularer Ebene ih- ren Anfang. Die Erzeugung und H a n d h a b u n g molekularer Strukturen hat vor diesem Hintergrund einerseits zu sehr innovativen Ent- wicklungen im Bereich der biomimetischen Materialien geführt und schafft andererseits zwingend die Verbindung zur Mikro- und Na- notechnologie.
Der Medizintechnik im Allgemeinen und der Biomaterialforschung im Speziellen hat die Thüringer Landesregierung seit j e h e r eine prioritäre Bedeutung beigemessen. Forschung und Entwicklung auf dem Gebiet der Grenzflächenfunktionalisierung und der Biointer- faces ist mit dem Slogan „Biotechniques at Interfaces" einerseits originäre Aufgabe des iba Heiligenstadt e.V. und andererseits zentra- ler Förderschwerpunkt in der gesamten Region Thüringen. Ausdruck dessen ist z.B. die Förderung eines Schwerpunktprogramms z u m Thema „Biointerfaces" durch die Thüringer Landesregierung im Zeitraum 2007 - 2010 und der Umstand, dass wir in Kürze im u n - mittelbaren Umfeld des iba Heiligenstadt e.V. ein Kompetenzzentrum für „Grenzflächenfunktionalisierung und Biointerfaces" in Betrieb nehmen und damit die Arbeitsmöglichkeiten auf diesem hochinnovativen Gebiet der interdisziplinären Materialforschung nochmals deut- lich verbessern werden.
Es ist vor diesem Hintergrund sicher sehr verständlich, dass wir den thematischen Hintergrund der diesjährigen Tagung inhaltlich e n t - sprechend fokussiert haben. Die Resonanz auf unsere Ausschreibung war überwältigend, so dass wir bei der Konzipierung des Pro- gramms leider nur etwa ein Drittel der gemeldeten Vorträge haben berücksichtigen können. Ich bitte daher insbesondere die Autoren der nicht berücksichtigten Beiträge ausdrücklich um Verständnis.
Die Thüringer Arbeitsgemeinschaft Biomaterial e.V. und das Institut für Bioprozess- und Analysenmesstechnik e.V. freuen sich als Gast- geber der Jahrestagung der Deutschen Gesellschaft für Biomaterialien vom 18.-20. November 2010 auftreten zu dürfen. Wir möchten dem Vorstand der Deutschen Gesellschaft für Biomaterialien e.V. für das in uns gesetzte Vertrauen sehr herzlich danken und hoffen, dass die Kurstadt Heilbad Heiligenstadt mit ihrem regionalen Flair und ihrer über tausendjährigen Geschichte einen interessanten Rahmen für den interdisziplinären Austausch neuester Ergebnisse aus Wissenschaft und Forschung bildet.
Ihr
ι<X
Ihr
10 je-
Prof. DrJKlaus Liefeith
Institut für Bioprozess- und Analysenmesstechnik e.V. (iba) Leiter Fachbereich Biowerkstoffe
Rosenhof · 37308 Heilbad Heiligenstadt
^ j j B I O m a t e r i a l i e n 11 ( N o v e m b e r ) , 2 0 1 0
DGBM
Jahrestagung der
Deutschen Gesellschaft für Biomaterialien
2010
m v R vi
18.-20. November 2010 Gewebeersatz/Geweberegeneration:
Von der Grenzfläche zum Biointerface
Tagungspräsident:
Prof. Dr. Klaus Liefeith
Institut für Bioprozess- und Analysenmesstechnik e.V.
Ort der Veranstaltung:
Stadthalle, Aegidienstraße 20, 37308 Heilbad Heiligenstadt
Veranstalter:
1P4G
BIOMATERIAL
Thüringer Arbeitsgemeinschaft Biomaterial e.V.
^ 2 BlOmaterialien 11 (November), 2010
Institut für Bioprozess- und Analysenmesstechnik e.V.
Vorstand der
Deutschen Gesellschaft für Biomaterialien e.V.
Geschäftsführender Vorsitzender:
Prof. Dr. M. Epple Universität Duisburg-Essen Institut für Anorganische Chemie
Universitätsstraße 5-7 45117 Essen Tel.: 0201 183 24 13
E-Mail: matthias.epple@uni-due.de
Schriftführer:
PD Dr. S. Rammelt
Klinik und Poliklinik für Unfall- und Wiederherstellungschirurgie Universitätsklinikum Carl Gustav Carus der TU Dresden
Fetscherstraße 74 01307 Dresden Tel.: 0351 458 22 08
E-Mail: stefan.rammelt@uniklinikum-dresden.de
Kassenwartin:
PD Dr. B. Nebe
Zentrum für Medizinische Forschung Universität Rostock
Schillingallee 69 18057 Rostock Tel.: 0381 494 77 71
E-Mail: barbara.nebe@med.uni-rostock.de
Vorstandsmitglied für besondere Aufgaben:
Prof. Dr.-Ing. habil. H. Worch Institut für Werkstoffwissenschaft
Technische Universität Dresden 01062 Dresden Tel.: 0351 46 33 43 36 E-Mail: hartmut.worch@tu-dresden.de
^ 2 i B I O m a t e r i a l i e n 11 (November), 2010
ABSTRACTS
LA C
Freimark, D. KSV 02A b d El-Aal, A.M. FTP 03 Calließ, T. MBP 0 3 Frerich, B. HGP 12
A d a m , M. HGP 12 Cebotari, S. GTV 04 Friess, W. FTP 20
A d a m , S. GTP 02, FTP 16 Cherif, C. FTP 12 Fröber, U. KSV 03
Ahrem, Η. K T P 0 1 C h e r n o u s o v a , S. HGV Ol Frotscher, M. W G V 0 5
Albrecht, Η. KEP 13 Chichkov, B. KTV 04, WGP 05
Albrecht, V. MBP 04 Christel, A. FTP 09, FTP 11
Aleksic, Ζ. HGP 01 Cornelsen, M. KEP 07
G
Alt, R. FTP Ol Czermak, P. KSV 02 Gao, W. FTP 08
Alt, V. KEV 04 Gbureck, U. KTP 02, HGP 05
A n d e r e g g , U. WGP 14 HGP 08
A r m b r u s t e r , F.P. HGP 10
D
Geis-Gerstorfer, J. HGV 04, HGP 14Arndt, Κ. MBP 0 5 Damink, L.O. KTV 03 Gelinsky, M. HGV 02
A s s m a n n , C. G T V 0 1 David, D. KTP Ol Gellynck, K. KTV 02
Avci-Adali, Μ. GTV 02 D a y y o u b , E. MBP 06 G e m m i n g , S. HGP 17, KEP 15
de Wild, M. KEP 13 Genzel, S. WGP 06
Β
Deisinger, U. KEV Ol, KEP 10 Georgi, N. KTP 08Β
Dempwolf, W. MBV 04, MBP 0 3 G e r a r d y - S c h a h n , R. FTP 11Bach, F.-W. GTV 04 HGP 06 Gerber, T. HGP 12
Badar, Μ. MBP 01, MBP 02 Deniz, 0 . GTV 02 Gitter, B. MBP 04
Bader, R. MBP 05, HGP 04 Derks, M. KTP 06 Glorius, S. HGP 18
Barcikowski, S. MBV 06 Despang, F. HGV 02 Gocke, C. WGP 12
Bartneck, M. WGP 07, WGP 10 Detsch, R. KEV Ol, KEP 10 Goepferich, A. KTP 04
Baumert, R. MBV 0 3 Dettling, M. WGP 04 Goepfert, C. KSV Ol
Becher, J. K T V 0 1 Diendorf, J. KEP 11 G o l d m a n n , T. HGV 0 5
Beck, U. FTP 10 D i t t m a n n , A. KSV Ol Gonzalez-Calbet, J.M. HGV 01
Behrend, D. MBV 05, HGV 04 Dittrich, B. WGP 11 G o v i n d a r a j u l u , P. «FTP 12
HGP 14, KTP 09 Dittrich, R. HGV 02 Grade, S. MBV 06
Behrens, B.-A. HGV 06, HGP 15 D o r f m a n , S. GTV 03 Graf, H.-L. HGP 10
Behrens, P. HGV 03, MBP 01 Dörr, D. FTP 14 Greiner-Petter, C. HGP 09
HGP 07, FTP 09, Drücker, H. KEV 06 Greulich, C. KEP 11
FTP 11, FTP 22 Duncker, G.I.W. WGV 04 Grimm, G. HGP 02
B e r g e m a n n , C. KEP 03, FTP 06 Dürselen, Ι- KTV 02 G r o h m a n n , S. WGV Ol
B e r n h a r d t , A. HGV 02 Groll, J. WGP 07, W G P 10
B e r n h a r d t , R. KEP 01 KEP 04
Bernstein, A. K T V 0 6
Ε
Gross, G. MBV 04, HGP 06Berthold, A. KEP 08 Eberhard, J. MBP 10 Gross, U. KTP 07
Betancur, S. HGV 06, HGP 15 Eggeier, G. WGV 0 5 Große-Siestrup, C. KTP 07
Betz, V. FTP 08 Ehlert, N. MBP Ol Groth, T. FTP 02
Bienengräber, V. HGP 01 Eick, S. MBP 07 Guder, E. KTP 09
Biewener, A. KEP 01 Ellenrieder, M. HGP 04 Guebitz, G. FTP 20
Bischoff, B. KEP 09 Emmrich, F. FTP Ol Guntinas-Lichius, 0 . HGP 09
Biskup, C. GTV 04 Engelhardt, S. KTP 0 5
Blunk, T. KTP 04 Epple, M. HGV Ol, MBP 0 4
Boeuf, S. KEP 06
Epple, M.
KEP 11, FTP 0 4
Η
B o g d a n o w i c z , R. MBP 0 5 FTP 14, FTP 21 Haasper, C. KSV 0 5
Böhm, S. FTP 11 Eummelen, L. KTV 0 3 Haberland, C. KEV 02
Boldhaus, S. HGP 0 3 Habijan, T. KEV 02
Boldt, A. FTP 01 Haenle, M. HGP 0 4
Borchers, K. KTP 05, GTP 01
F
Hagmeyer, D. FTP 0 4Borschers, K. GTV 01 Fabry, Β. KEV 0 5 Hahnel, S. MBV 0 5
Bossert, J. MBP 08 Farack, J. HGP 18 Hampl, J. KSV 04
B o u g u e c h a , A. HGV 06, HGP 15 Feher, K. WGP 11 Handel, G. MBV 0 5
Brandt, C. HGV 04 Feil, L.-M. KEP 10 H a r t m a n n , H. WGV 02
Braun, R. KEP 12 Felisch, S. MBV 03 Harverich, A. GTV 0 3
Breier, A. KEP 01, KEP 09 Fernekorn, U. KSV 04 Hassel, T. GTV 0 4
FTP 12 Feyerabend, F. KEV 06 Hauser, H. MBP 02
Bremer, I. FTP 11 Fiedler, J. KEP 04 Hauser, J. WGP 13
Brenner, R. KEP 04, HGP 03 Fischer, H. KEV 03, HGP 17 Haverich, A. GTV 04, KTP 06 B r o c h h a u s e n , C. KTP 07 Fischer, J. KEV 06 Heffels, K.-H. WGP 07, WGP 10
Bröse, M. KSV 0 5 Fischer, S. FTP 02 Heider, A. FTP Ol
Budde, S. KSV 0 5 Förster, A. HGP 03 Heidrich, M. MBP 09
Buer, J. FTP 21 Förster, Y. FTP 08 H e i m a n n , L. KEV Ol
Bühren, A. K T V 0 3 Forstreuter, I. WGV 03 Hein, T. KEP 0 4
Bürgers, R. MBV 0 5 Frant, M. MBV Ol Heini, P. KEP 0 3
Burghardt, I. KEP 05 Franz, S. WGV 03 Heinrich, G. FTP 12
^ ^ B l O m a t e r i a l l e n 11 (November), 2010
Heinze, Τ. FTP 17 Kassab, E. WGV 0 5 Leijten, J. KTP 0 8 Heiß, C. KEV 0 4 K a u f m a n n , M. W G P 04 Lenarz, T. HGV 03, WGP 0 5
Heisterkamp, Α. MBP 0 9 Kellner, M. MBP 09 WGP 06, WGP 0 8
Hempel, U. FTP 08 Kern, D. FTP 10 Lennarz, T. MBP 0 2
Henke, Μ. KTP 04 Kessler, 0 . K T V 0 2 Lensing, R. HGV 0 3
Henrich, L. WGP 13 Khlusov, I. KEP 14 Lenz, S. HGP 12
Hering, B. HGP 07, FTP 22 Kietzmann, M. WGP Ol Lerch, M. HGV 0 6
H e r r m a n n , A. KTP 09 Kinne, R.W. KTP Ol Liefeith, K. MBV Ol, WGV Ol
Herzlieb, W. HGP 0 5 Kirchhoff, M. HGP 12 KSV 03, HGP 13
Heschel, I. K T V 0 3 Kirkpatrick, J.C. KTP 07 Linde, D. HGP 02, HGP 0 9
Heß, J. MBP 07 Kirsten, A. HGP 17 Lindner, M. KEV 03, HGP 17
Heß, R. KEP 09 Kittel, S. MBP Ol Lindner, T. HGP 0 4
Hess, R. KEP Ol Kittinger, C. MBV 0 3 Linow, U. WGP 0 9
Heuer, W. MBV 04 Klee, D. WGP 11 Lips, Κ. KEV 0 4
H e u m a n n , R. H G V 0 1 Kleffner, B. HGP 0 3 Litschko, P. HGP 0 2
Hilbig, H. HGP 10 K l e i n , A . FTP 20 Löbler, Μ. WGP 12
Hild, A. KEP 12 Klein, C. FTP 18, FTP 19 Löffler, R. FTP 10
Hildebrand, G. KSV 0 3 Kleinhans, C. KEP 02 Lorbeer, R.-A. MBP 0 9
HGP 13 Klemm, D. KTP Ol Lorenz, C. MBV 04, HGP 0 6
H il dmann, C. KSV 04 Klesing, J. HGV Ol, MBP 0 4 Lüdecke, C. MBP 0 8
Hilfiker, A. GTV 03, KTP 06 Klett, M. KSV 0 4 Luderer, F. MBP 10
Himmlova, L. HGV 0 5 Klinkenberg, E.-D. KEP 03, FTP 06 Lurtz, C. HGV 0 4
Hinte, N. GTV 04 Kluger, P. GTV Ol, KEP 0 2 Lüßenhop, T. MBP Ol
Hintze, V. WGV 03, W G P 14 KTP 05, GTP Ol Lüthen, F. KEP 0 5
Hippler, R. MBP 0 5 Knoll, W. HGP 11 Lutz, R. HGP 16
Hirth, T. GTV Ol, W G P 04 Knuschke, T. FTP 21
KEP 02, KTP 05, GTP Ol Kobuch, K. WGV 0 4
Hoch, E. KTP 0 5 Koch, L. K T V 0 4 Μ
H o f f m a n n , A. MBV 04 Koczur, K. HGP 17 Maier, G. KTP 0 4
HGP 06, FTP 09 Köhler, K. HGP 0 5 Maier, K. KEP 13
H o f f m a n n , M. KEP 06 Koller, M. KEV 02, KEP 11 Mani, S. HGV 0 2
FTP 18 Konstantinovic, V.S. HGP Ol Marth, E. MBV 0 3
FTP 19 Kopp, S. HGV 05, HGP Ol Matschegewski, C. FTP 10
H o f f m a n n , P. FTP 18, FTP 19 Körbs, T. HGP 02 Mayer, C. FTP 0 4
H o f m a n n , N. HGP 0 5 Körner, C. KEP 0 3 Mayr, H. K T V 0 6
Höges, S. KEV 0 3 Kovtun, A. HGV Ol Meier, H. KEV 0 2
Hort, N. KEV 06 Kozlova, T. KEP 14 Meißner, M. HGP 17
Horvath, T. GTV 0 3 Kramer, S. WGP 08 Meister, F. FTP 17
Hossfeld, S. WGV 02 Kranz, I. HGP 0 4 Menzel, H. MBV 04, MBP 0 3
Hubicka, Z. MBP 0 5 Krastev, R. WGV 02 HGP 06, WGP 0 5
Kreja, L. K T V 0 2 WGP 06, HGP 07, FTP 22
Krettek, C. KSV 05 Metzger, M. FTP Ol
I Kriegelstein, H. HGP 13 Metzger, R. FTP Ol
Ignatius, A. K T V 0 2 Krüger, H. GTP Ol Meuche, F. FTP 18
Ihde, S. HGV 05, HGP Ol Kufelt, 0 . MBP Ol Meyer, H. MBP 0 9
Ismail, A.A. FTP 03 Kühn, K.-D. MBV 02, MBV 03 Meyer, M. FTP 20
Kühnel, M. MBP 09 Meyer, S. KSV Ol
Kunz, F. FTP 06 Meyer, T. GTV 0 4
J Meyer, W. GTP Ol
Jagodzinski, M. KSV 0 5 Mihailova, B. KEV 0 6
J a n d t , K.D. MBP 08 L Mildner, R. WGP 0 5
J a n ß e n , R. KSV Ol Läffert, A. KSV 04 Mittelmeier, W. HGP 0 4
Jennissen, H.P. HGP 17 Lang, R. MBV 0 5 Mittnacht, U. WGV 02
Jeuthe, S. KTP 07 Lange, M. FTP 18 M o e i l m a n n , R. WGP 09, KEP 08
J o h n , A. HGV 02 Lange, R. FTP 10 Moje, H.-J. HGP 13
Judith, J. HGP 03 Langer, I. FTP 13 Möller, M. W G P 11, KEP 0 4
Jus, S. FTP 20 Langer, S. WGP 13 Möller, S. WGV 03, K T V 0 1
Langheinrich, A. KEV 0 4 WGP 14
Laub, M. HGP 17 M ö l l m a n n , U. MBP 02
Κ Laube, T. WGP 0 3 Monchev, B. WGV 0 5
Kadegge, G. KTP 04 Laue, M. KEP 0 3 Mueller, P. MBP 0 2
Kainer, K.U. KEV 06 Leal-Egana, A. GTV 0 5 Mühlberg, L. KEP 06
Kalkhof, S. FTP 08 Leemhuis, H. K T V 0 3 Müller, B. HGP 13
Karlov, A. KEP 14 LeHarzic, R. FTP 14 Müller, C.K. WGV 0 6
Karperien, M. KTP 08 Lehnert, M. HGP 11 Müller, M. GTV Ol, KEP 02
Kasper, C. FTP 09, FTP 11 Leicht, U. FTP 20 Müller, P. HGV 03
B l O m a t e r i a ü e n 11 (November), 2 0 1 0
ABSTRACTS C
Müller, P.P. MBP Ol Rebl, H. MBP 05 Schober, A. KSV 04
Müller, R. FTP 07 Reich, U. WGP 06 Schöbitz, M. FTP 17
Müller, S. GTV 05 Reichel, H. HGP 03 Schönhaar, V. WGP 04
Müller-Mai, C. HGP 17 Reinauer, F. HGP 03 Schreyer, A. KEV 06
Murua Escobar, H. FTP 03 Reinhold, R. KEP 14 Schubert, H. WGP 09, KEP 08
Rentsch, B. KEP Ol, KEP 09 KTP 07
Rentsch, C. KEP Ol, KEP 09 Schubert, U.S. HGP 02
Ν Rettier, E. HGP 02 Schügner, F. KTV03
Natan, C. KEP 08 Reuter, G. WGP 06 Schuh, C. WGP 04
Nebe, B. MBP 05, KEP 03 Reuter, T. FTP 18 Schultze-Mosgau, S. WGV 06
FTP 06, FTP 10 Richter, H. FTP 23 Schumacher, A. WGP 04
Neelakantan, L. WGV 05 Richter, W. KEP 06 Schumacher, R. KEP 13
Neumann, B. FTP 16 Riediger, D. KEV 03 Schumacher, S. WGP Ol
Neumann, H.-G. KEP 05, FTP 16 Ring, A. WGP 13 Schunk, D. FTP 04
Neumann, S. HGV01 Robioneck, B. KEV 04 Schüttrumpf, J.P. KEP 12
Neumeier, M. FTP 14 Röhn, S. KSV01 Schwab, B. WGP 08
Neunzehn, J. FTP 13 Rosentritt, M.MBV 05, HGV 04, HGP 14 Schwab, E. GTV 05
Nies, Β. HGP 18 Rosin, C. HGP 11 Schwarz, C. KEP 07
Nolte, A. GTV 02 Roth, M. MBP 08 Schwenzer, B. HGP 03
Nolte, 1. HGV 06, FTP 03 Rothe, H. WGV Ol, HGP 13 Seidel, M.-L. FTP 02
Nonhoff, J. HGP 16 Ruesing, J. FTP 04 Seifert, G. HGP 17, KEP 15
Novosel, E. GTV 01, GTP 01 Ruiz, L. HGV Ol Seiffart, V. HGP 06
Rupprecht, B. HGP 13 Seitz, A. KTV02
Rychly, J. KEP 04, KEP 05 Seitz, H. KEP 07
0 GTP 02, FTP 16 Seitz, J.-M. WGP Ol, WGP 08
Oberst, I. KEP 12 Sei, S. WGV 04
Oliveira, A. KEP 15 Sen, Α. WGP 05, WGP 06
Olive ira, C. HGP 17 s Shenoy, S. HGV 02
Oliveira, H. WGV 02 Sack, U. FTP Ol Simon, A. KSV 05
Öri,
F. HGP Ol Salamon, A. GTP 02, FTP 16 Simon, J.C. WGV 03, WGP 14Ottl, P. HGV 04, HGP 14 Salier, M.M. KEP 07 Skaer, N. KTV02
Otto, Κ. WGP 02, HGP 09 Samy, M.T. FTP 03 Sluszniak, M. MBV 04, MBP 03
Otto, S. KEP 07 Sauer, D. FTP 14 Smeets, R. KEV 03
Sauerbier, S. FTP 19 Smith, A. GTV 05
Schacht, K. GTV 05 Sokolova, V. FTP 21
Ρ Schade, R. MBV Ol, KSV 03 Sonntag, F. KTV05
Paasche, G. WGP 06, KTP 09 Schaffran, A. WGP 13 Southan, A. WGP 04
Pau, H.W. KTP 09 Scharnweber, D. WGV 03, WGP 14 Spieß, K. GTV 05
Pavlidis, T. KEP 12 HGP 03, HGP 18 Stachel, I. FTP 20
Pawar, K. FTP 07 KEP Ol, KEP 09 Stahl, J. WGP Ol
Pego, A.-P. WGV 02 Scheibel, T. GTV 05 Stählke, S. FTP 10
Peschel, D. FTP 02 Scheper, T. FTP 11 Standke, G. HGP 18
Peters, K. GTP 02, FTP 16 Scherf, A. HGP 09 Staudenmaier, R. KTP 04
Petri, Μ. K S V 0 5 Scheurer, W. KSV Ol Steen, D. MBP 04
Pfaffenroth, C. MBV 04, MBP 03 Schieker, M. KEP 07, FTP 20 Steinau, H.-U. WGP 13
Ρ fister, W. MBP 07 Schiller, J. KTV01 Stengler, R. FTP 15
Pichlinski, P. KEV01 Schilling, T. GTV 04 Sternberg, K. MBP 10
Plettenberg, H. FTP 18 Schlechte, A. KEV Ol Stiesch, M. MBV 04, MBV 06
Podbielski, A. MBP 05 Schlegel, K.A. HGP 16 HGV 04, MBP 02, MBP 03
Pohl, M. FTP 17 Schlie, S. WGP 05 MBP 09, MBP 10, HGP 14
Pörtner, R. KSV01 Schliephake, H. HGP 03 Stieve, M. HGV 03, MBP 02
Prechtl, C. HGP 16 Schlögl, W. FTP 20 Stoll, D. WGV 02
Prinz, C. KEP 05, FTP 16 Schlögl, W. FTP 20 Storsberg, J. WGV 04
Probst, F. KEP 07 Schlosshauer, B. WGV 02 Stracke, F. FTP 14
Przemeck, S. FTP 23 Schmitz, K.-P. HGV 04, WGP 12, Stranak, V. MBP 05
Pufky-Heinrich, D. WGP 04, KTP 05 KTP 09 Stubenrauch, M. KSV 03
Pufky-Heinrich, D.
Schmitz, T. HGP 08 Stuckensen, K. KTP 02
Schnabelrauch, M. WGV 03, KTV01 Stukenborg-Colsmann, C.
Q MBP 02, WGP 03 HGV 06, HGP 15
Quadbeck, P. HGP 18 WGP 14, HGP 02 Stumpp, S.N. MBP 10
Schneider, G. WGP 02, HGP 02 Südkamp, N. KTV06
HGP 09, FTP 05
R Schneider, H. FTP Ol
Raab, B. HGP 16 Schneider, Ma. GTV 02 Τ
Rammelt, S. FTP 08 Schneider, Mi. KEP 13 Telle, R. KEV 03
Rathjen, B. KSV01 Schnettler, R. KEV 04, KEP 12 Tessmar, J. KTP 04
^ ^ j B I O m a t e r i a l i e n 11 ( N o v e m b e r ) , 2 0 1 0
Thorwarth, Μ.
Thude, S.
Torna, I.
Tovar, G.
Tovar, G.E.M.
Tschumi, S.
Tudorache, I.
WGV 06 WGP 04 KSV 0 5 KTP 05, G T P 0 1 WGP 04 KEP 13 GTV 04
W i ß m a n n , G.
Witte, H.
Wohlfeil, M.
W o h l r a b , S.
W o l f - B r a n d s t e t t e r , C.
Worch, H.
Wurster, S.
HGP 07, FTP 22 K S V 0 3 HGP 14 GTV 0 5 HGP 18 HGP 18 GTV Ol, KEP 02
u
Ullrich, F.
Vallet-Regi, M.
van Blitterswijk, C.
v a n der Smissen, A.
Veith, M.
Vogt, C.
Voigt, S.
Volkmer, E.
v o n Bergen, M.
v o n S c h w a n e w e d e , H.
Vukadinovic, Z.
KTP 09
H G V 0 1 KTP 08 W G P 14
HGP 11 MBP Ol HGP 09, FTP 0 5
FTP 20 FTP 08 HGV 04, HGP 14
GTV 0 3 Y
Yugoslav, V.
Ζ
Zdenek, Η.
Zehbe, R.
Z h a n g , Κ.
Ziegler, G.
Ziemer, G.
Zietz, C.
Z i m m e r m a n n , H.
Zoll, A.M.
Zurlinden, K.
Zwadlo-Klarwasser, Zwipp, H.
HGP Ol
HGV 0 5 KTP 07 FTP 02 KEV Ol, KEP 10 GTV 02 MBP 0 5 FTP 14 FTP 15 HGP 17 G.
W G P 07, WGP 10 KEP Ol, FTP 08
W
Wagener, P.
Wagner, A.
Wagner, S.
Waizy, H.
Walker, T.
Walles, H.
Waraich, S.
Warkentin, M.
Wefstaedt, P.
Wegener, Μ.
Wehmeier, Μ.
Weidner, Ν.
Weigel, Ν.
Weinhold, W.P.
Weise, F.
Weisel, T.
Weiss, D.
Weiß, T.
Weisser, J.
Weltrowski, A.
Wendel, H.
Westendorf, A.
Wetzel, J.
Wiegandt, K.
Wiese, H.
W i e s m a n n , H.-P.
W i g g e n h o r n , M.
Will, F.
Williams, S.
Willumeit, R.
W i n d h a g e n , H.
W i n d h a g e r , R.
MBV 06 MBP 07 FTP 03 HGP 15 GTV 02 GTV Ol, WGP 0 4 KEP 02, GTP Ol HGP 07, FTP 22 HGV 04, KTP 0 9 HGV 06, FTP 03 GTP Ol K S V 0 5 FTP 07 HGV 06, HGP 15
FTP 15 KSV 0 4 HGP 16 KTV Ol KSV 03 WGP 03 FTP 02 GTV 02 FTP 21 FTP 06 KSV Ol KTP 0 4 FTP 13 FTP 20 FTP 23 FTP 09, FTP 11 KEV 06 MBV 04, MBP 03 HGP 06 MBV 03
^ 7 | B I O m a t e r i a l i e n 11 (November), 2010
ABSTRACTS
Inhaltsverzeichnis
Vorträge
Biomaterialien im Kontakt mit Mikroorganismen/Biofilmen (MBV Ol - MBV 06) Biomaterialien im Kontakt mit dem Weichgewebe und Blut (WGV 01 - WGV 06) Biomaterialien im Kontakt mit dem Hartgewebe (HGV 01 - HGV 06)
Biomaterialien für das Knochen-Tissue Engineering (KEV 01 - KEV 06) Biomaterialien für das Knorpel-Tissue Engineering (KTV 01 - KTV 06) Biomaterialien für das Gefäß-Tissue Engineering (GTV 01 - GTV 05) Bioreaktor-basierte Kultivierungsstrategien (KSV 01 - KSV 05)
Poster
Biomaterialien im Kontakt mit Mikroorganismen/Biofilmen (MBP 01 - MBP 10) Biomaterialien im Kontakt mit dem Weichgewebe und Blut (WGP 01 - WGP 14) Biomaterialien im Kontakt mit dem Hartgewebe (HGP 01 - HGP 18)
Biomaterialien für das Knochen-Tissue Engineering (KEP 01 - KEP 15) Biomaterialien für das Knorpel-Tissue Engineering (KTP 01 - KTP 09) Biomaterialien für das Gefäß-Tissue Engineering (GTP 01 - GTP 02) Freie Themen (FTP 01 - FTP 23)
59-64 65-70 71-77 78-83 84-89 90-94 95-100
101-110 111-124 125-144 145-159 160-167 168-169 170-192
^ Q B l O m a t e r i a l i e n 11 (November), 2 0 1 0
MBV 01
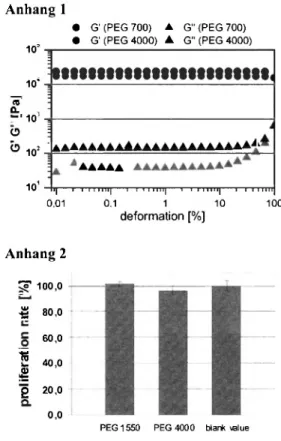
*M. Frant, R. Schade, Κ. Liefeith
Entwicklung klinisch validierter in v/iro-Testsysteme auf der Basis mikrobiologischer Infekti- onsmodelle für die Prüfung von Implantatwerkstoffen
Einleitung
Biomaterial-assoziierte Infektionen bergen ein enormes gesundheitliches Risikopotenzial. Unabhängig vom Me- dizinprodukt gilt universell, dass die Bildung eines mik- robiellen Biofilms die Präsenz pathogener Keime und damit die Ursache der Komplikationen darstellt. Dabei variieren die Keimzahl und -menge sowie die Struktur des Biofilms in Abhängigkeit vom Applikationsort und Nutzungsdauer des Implantates und bestimmen so das In- fektionspotenzial.
Lösungsansatz
Um die Infektionsbestimmenden Wechselwirkungen an Biomaterialoberflächen applikationsnah und reproduzier- bar messen zu können, müssen technische Systeme be- reitgestellt werden, in denen die jeweiligen Interaktionen unter einsatzrelevanten Bedingungen ermittelt und inter- pretiert werden können. Im Rahmen biologischer Testun- gen werden hierfür Bioreaktoren eingesetzt, welche die Basis fur klinisch validierte in v/'/ro-Testsysteme darstel- len und eine vielseitige Prüfung potentieller Biomateria- lien erlauben. Es wurde ein Bioadhäsionsmessplatz etab- liert, der auch eine strömungsmechanische Bewertung hinsichtlich der eingesetzten Fliessbedingungen ermög- licht.
Applikation
Beispielhaftes Entwicklungsziel war zum einen die Mi- nimierung katheterinduzierter Infektionen peritonealer Dialysekatheter. Im Rahmen der biologischen Prüfung wurde ein spezifisches in v/>o-Modell der peritonealen Dialyse entwickelt. Die Aufnahme von Adhäsionskineti- ken erfolgte in Fliesskammern im online-Verfahren. Es konnte eine signifikant reduzierte bakterielle Adhäsion
für die Tetraetherlipid-basierten Antifoulingschichten demonstriert werden unter Erhalt der Zellvitalität.
Die Optimierung des komplexen Infektionsmodells setzte sich in der Entwicklung neuer antiinfektiver und inkrus- tationshemmender Schichten für Harnwegskatheter fort.
Es wurde zunächst der Aufbau eines bakteriellen in vitro- Mischkulturmodells des Urintraktes realisiert. Des- wei- teren erfolgte die Simulation der physiologischen Umge- bung zur Bildung von Inkrustationen an Harnwegskathe- ter-oberflächen mit einer erfolgreichen klinischen Vali- dierung.
Letztendlich entstand ein validiertes in vzYra-Testsystem der Plaquebildung für die biologische Prüfung von Im- plantatmaterialien in der dentalen Prothetik.
' • r
", * t / Λ V J
i, ~ . , . .
Abb. 1: REM-Aufnahmen der infektiösen Inkrustation, 500x
links: in v/iro-Inkrustation nach 4 Wochen
rechts: Harnleiterschiene nach 6 Wochen im Patienten
Korrespondenzanschrift Marion Frant
Institut für Bioprozess- und Analysenmesstechnik e.V.
Rosenhof
37308 Heilbad Heiligenstadt Deutschland
^ φ I B I O m a t e r i a l i e n 11 (November), 2010
ABSTRACTS
ΡMBV 0 2
*K.-D. Kühn
Neue anti-infektive Beschichtungsstrategien für medizinische Implantate
Einleitung
Zur anti-infektiven Ausrüstung von Implantaten bieten sich Antibiotika/Antiseptika (AB/AS) Fettsäurekomplexe an, die durch einfache Umsalzung hergestellt werden können [1],
Ergebnisse
Die neuartigen Fettsäurekomplexe sind zumeist weißli- che bis gelbliche feinkristalline, wachsartige und doch fließfähige Pulver. Die wirksamen Bestandteile der Aus- gangsmoleküle der eingesetzten Wirkstoffe bleiben dabei stets unverändert. Die durch solchen Salzaustausch her- gestellten Feststoffe können zur Weiterverarbeitung be- quem in ethanolischen Lösungsmitteln gelöst werden und mittels eines Sprüh- bzw. Tauchverfahrens leicht zur Be- schichtung verschiedener Implantate eingesetzt werden.
Je nach ausgewählter Beschichtungsmethode entstehen dabei gleichmäßige und dünne Beschichtungen auf den Implantaten. Die eingesetzten A B / A S Fettsäurekomplexe erweisen sich dabei stets als wachsartige Feststoffe, die an den ausgewählten Implantatoberflächen leicht haften.
Beschichtungen auf rauen Oberflächen können dabei so gewählt werden, dass eine leichte Rauigkeit erhalten bleibt. Besonders hervorzuheben bei diesen Beschichtun- gen ist der Wegfall jeglicher zusätzlicher Trägerschich- ten. Vielmehr ist es der Wirkstoff selbst, der an der Ober- fläche haftet. Je nach Einsatzgebiet ist das Freisetzungs- verhalten der jeweiligen Wirkstoffe leicht einstellbar. Die Freisetzung der Wirkstoffe zeigen in der Regel eine hohe Elutionsrate in den ersten 24-48h und eine weitere prot- rahierende Wirkstoffabgabe in den Folgetagen. Je nach Beladungsdichte kann die Freisetzung bis zu einigen Ta- gen bis wenige Wochen betragen. A u f g r u n d der hohen Freisetzung der Wirkstoffe in den ersten Stunden posto- perativ, weisen die beschichteten Implantate rasch wieder eine ursprünglich unbeschichtete Oberfläche auf. Die ex- zellente Wirksamkeit der verschiedenen A B / A S Fettsäu- rekomplexe kann leicht in-vitro im Proliferationsassay gegen Staphylococcus epidermidis D S M 18857 getestet werden. Auch im Hemmhoftest erweisen sich die neuen Beschichtungen als hochwirksam, wie die als Referenz
mit getesteten Wirkstoffen vor ihrer Umsalzung. Alle durchgeführten Tests zur Biokompatibilität fur die neuen Beschichtungen erfüllen die ISO-Norm 10993.
Diskussion
Implantat-assoziierte Infektionen nehmen zu und stellen nach wie vor ein ernstzunehmendes Risiko in der Medi- zin dar. Perioperativ ist das Risiko besonders hoch, dass sich Keime auf einer Implantatoberfläche ansiedeln.
Postoperativ dienen Implantate als Rückzugsort für Kei- me, von denen leicht Rezidive ausgehen können [2], Me- tastudien in den USA mit einem großen Patientenkollek- tiv zeigen eine nachhaltige Senkung des Infektionsrisikos von Implantaten bei der Verwendung von Antibiotika zur Prophylaxe am Beispiel von antibiotikahaltigen Kno- chenzementen [3], Die vorgestellten neuartigen anti- infektiven Beschichtungen von Implantaten weisen neben einer Barrierewirkung auch eine aktive Wirkstoffabgabe auf und dienen dem prophylaktischen Schutz des Implan- tats vor einer Keimbesiedelung. Diese Fettsäurekomplexe können daher einen wichtigen Beitrag zur Infektvermei- dung von Implantaten leisten.
Literatur
[1] Vogt et al (2003) Porous implants with antibiotic coating, their preparation and use. EP 1374923 B1 [2] Frommelt, L. (2004) Local antibiotic therapy.
In:Schnettler, Steinau: Septische Knochenchirurgie (82- 90), Stuttgart, Thieme Verlag
[3] Parvizi et al (2008), Efficacy of antibiotic-
impregnated cement in total hip replacement, Acta Or- thop. 79(3), pp. 335-341
Korrespondenzanschrift PD KD Klaus-Dieter Kühn Heraeus Medical G m b H Philipp-Reis-Straße 8/13 61273 Wehrheim Deutschland
BlOmateriallen 11 (November), 2 0 1 0
MBV 03
*C. Kittinger, E. Marth, R. Windhager, R. Baumert, S. Felisch, K.-D. Kühn
A quick force against bacterial infection in orthopedic surgery
Bacterial infections are a severe problem in orthopedic implant surgery and can cause life threatening complica- tions ranging from serious infections up to osteomyelitis.
The highest risk for an infection is the time during sur- gery or directly after implantation, where we have a mas- sive irritation of the surrounded tissue which promotes growth and colonization of possible existing germs.
Besides antibiotic prophylaxis and ongoing therapy after surgery many different ways of fighting bacteria have been established and are still in development. The spec- trum lasts from the addition of antibiotics to bone ce- ment, to special hydrophobic coverages of implants or metal ions.
In our study we tried to evaluate the antimicrobial effect of a novel gentamicin (as palmitat) coverage on titanium discs (Tilastan®) in comparison to gentamicin (as sul- phate) loaded acrylic bone cement (PMMA), of which the physical/chemical parameters have been described accurately, as bone cement is in use for a long time.
We compared the antimicrobial efficiency of these mate- rials in different tests. We tested the ability of the mate- rials to avoid bacterial adhesion, and their resistance against bacterial colonization in suspension testing. Addi- tionally we performed kinetic experiments were we incu- bated our discs and moulds with S.aureus and took sam-
ples over a period of time, to get a glimpse on antibiotic release and kill rates over time.
In our experiments we could show that discs and moulds inhibit bacterial growth on their surface (adherence test- ing) and emit enough antibiotic to eliminate a high germ number (suspension testing).
In our kinetic studies bacterial numbers showed a rapid decrease within the first hour. We could detect narrow differences between the different materials and gentami- cin concentrations. Our Tilastan® discs reduced the start- ing germ number from 106 germs/mL to around zero within the first half hour which was comparable to the equal amount of added gentamicin base.
Gentamicin palmitat covered discs show an excellent and rapid release within the first hours/days and are therefore an excellent tool for fighting early bacterial wound infec- tion/contamination post op.
Korrespondenzanschrift Dr. Clemens Kittinger Medizinische Universität Graz
Institut für Hygiene, Mikrobiologie und Umweltmedizin Universitätsplatz 4
8020 Graz Österreich
1 BlOmaterialien 11 (November), 2010
ABSTRACTS
MBV 04
*W. Dempwolf, C. Lorenz, C. Pfaffenroth, Μ. Sluszniak, A. Hoffmann, A. Winkel, W. Heuer, Μ. Stiesch, G. Gross, H. Windhagen, H. Menzel
Ultra thin polymer layers as custom made solution for medical applications
Titanium and its alloys are widely used as implant mate- rials due to their good biocompatibility and mechanical properties. With the help of polymeric coatings implant surfaces can be adjusted in their properties according to the needs of the application. The headwords to be hig- hlighted here are antimicrobial properties and improved integration of the implant into the bone - due to the fact that biofilm formation on medical implants is responsible for inflammatory processes or a non-perfect integration of an implant may result in an implant loosening.
However, with regard to the medical application several aspects have to be considered: First of all polymers have to bear structural characteristics which can be presumed to have an antimicrobial effect or provide an opportunity to attach signalling proteins (e.g. BMP-2) for a better os- seointegration. But besides these functional effects those polymers also have to be biocompatible.
To address these issues we covalently attach polymers onto titanium oxide surfaces via photochemical grafting onto [1] or utilizing the surface activity of phosphonates [2], respectively. The coating results in ultra thin polymer films at the nanometer scale.
I antimicrobial cationic group
surface active phosphonate group
Figure 1: Design of a copolymer bearing two functionali- ties - a surface active group for the ability to bind onto ti- tanium and a functional group (here an antimicrobial ca- tionic group).
Ellipsometry, contact angle, FT-IR-spectroscopy and XPS were used to characterize the chemistry and struc- ture of the copolymer films. An immunoassay and a cel- lular signalling system were used to characterize the amount of immobilized protein and the biological activity of the bound protein. The antibacterial activity is tested using fluorescence microscopy with live/dead assay for different germs. The biocompatibility of copolymers is determined on the basis of adhesion, proliferation, mor- phology and mitochondrial activity using LDH-, MTT- assays and microscopic evaluation of dermis fibroblasts [3] or human gingival fibroblast, depending on the appli- cation.
Antimicrobial properties
Based on the concept of membrane disrupting cationic macromolecules reported in literature we designed anti- microbial surfaces e.g. the copolymer system poly (vi-
nylbenzylphosphonate-co-hexylpyridinium) [3] combin- ing the biocompatibility and immobilization ability of phosphate groups with the antimicrobial effect of quar- ternized poly(4-vinylpyridinium).
Improved integration
For the covalent binding of BMP2 e.g. poly (4- vinylbenzyl) phosphonic acid diethylester-co-glycidyl methacrylate has been designed showing a high ability to bind the protein as determined by using an immunoassay.
The immobilized protein retains some biological activity as tested by a cellular signalling system.
a) ?
Figure 2: Synthesized copolymers: a) poly (vinylbenzyl- phosphonate-co-hexylpyridinium) [3], b) poly (4- vinylbenzyl) phosphonic acid diethylester-co-glycidyl methacrylate.
Both approaches show promising results and are interest- ing candidates for further testings.
Acknowledgement
This work was supported by the DFG as part of the SFB 599.
Literature
[1] Griep-Raming, N., Karger, M „ Menzel, Η., Lang- muir, 201, 11811,2004.
[2] Adden, N., Gamble, L. J., Castner, D. G., Hoffmann, Α., Gross, G., Menzel, Η. Biomacromolecules, 7, 2552, 2006.
[3] Heuer, W „ Winkel, Α., Kohorst, P., Lutzke, Α., Pfaf- fenroth, C., Menzel, Η., Bach, Fr.-W., Volk, J., Leyhau- sen, G., Stiesch, M. Advanced Biomaterials 2010, accep- ted.
Korrespondenzanschrift Dr. Wibke Dempwolf TU Braunschweig
TC Makromolekularer Stoffe Hans-Sommer-Str. 10 38106 Braunschweig Deutschland
fo 2 B l O m a t e r i a l i e n 11 ( N o v e m b e r ) , 2 0 1 0
MBV 05
*S. Hahnel, M. Rosentritt, R. Bürgers, D. Behrend, R. Lang, G. Handel
Untersuchung von weichbleibenden Unterfütterungsmaterialien hinsichtlich der Adhäsion von Candida albicans und Reinigungsfähigkeit
Fragestellung
Als Träger von Mikroorganismen wie Candida albicans können Prothesen aufgrund des unmittelbaren Kontaktes zur oralen Schleimhaut die Entstehung assoziierter Er- krankungen fördern. Weichbleibende Unterfütterungsma- terialien werden zur Schleimhautkonditionierung nach Extraktion oder Implantation verwendet; eine möglichst geringe Adhäsion von Candida albicans an ihre Oberflä- che sowie eine gute Reinigungsfahigkeit sind deshalb wünschenswert. Ziel der vorliegenden Untersuchung war es, die Adhäsion von Candida albicans an verschiedene weichbleibende Unterfütterungsmaterialien zu untersu- chen, und zu analysieren, inwieweit sich die unterschied- lichen Materialien in ihrer Reinigungsfahigkeit unter- scheiden.
Methoden
Standardisierte Prüfkörper aus vier weichbleibenden Un- terfütterungsmaterialien (Mucopren, GC Reline Soft, Si- lagum comfort, UFI Gel) wurden einem künstlichen Alte- rungsprozess (Thermocycling; 6000 Zyklen ä 5 min in destilliertem Wasser 5°/55°C ) unterzogen, und nach ei- ner Inkubation mit natürlichem Speichel (2 h) mit Candi- da albicans ATCC 10231 für einen Zeitraum von 2,5 h bzw. 24 h bei 37°C inkubiert. Die relative Anzahl adhä- renter Pilzzellen wurde mit Hilfe eines luminometrischen Verfahrens bestimmt. In einem zweiten Versuchsteil wurden die Prüfkörper vor Bestimmung der relativen Anzahl adhärenter Pilzzellen verschiedenen definierten Reinigungsprotokollen unterzogen (NaOCl, Prothesen- reiniger, Bürsten). Der Prozentsatz entfernter Mikroorga- nismen wurde im Verhältnis zu einer Kontrollbehandlung (Spülung mit Pufferlösung) ermittelt. Es wurden Mittel- werte und Standardabweichungen berechnet, und mittels einfaktorieller Varianzanalyse untersucht (ot=05).
Ergebnisse
Es konnten keine signifikanten Unterschiede in der rela- tiven Lumineszenzintensität zwischen den Materialien
festgestellt werden, was auf eine ähnliche Anzahl adhä- renter Pilzzellen hindeutet. Bei Anwendung von NaOCl bzw. dem Prothesenreiniger zeigten sich keine Unter- schiede in der Reinigungsfahigkeit zwischen den Mate- rialien; bei Anwendung des Bürstverfahrens zeigten sich nach einer Inkubationszeit von 24 h bei UFI Gel signifi- kant weniger entfernte Mikroorganismen als bei den an- deren Materialien.
Material NaOCl Prothesen- Bürsten reiniger
Inkubationszeit 2,5 h 24h 2,5 h 24h 2,5 h 24h Mucopren 97.6 97.4 86.5 42.4 95.1 92.2
(7.1) (3.4) (20.8) (29.4) (Π.0) (6.6) Silagum comfort 98.2 99.4 96.6 71.2 90.8 97.5 (1.0) (•9) (1.2) (27.8) (5.0) (1.4) GC Reline soft 99.3 99.3 78.7 70.9 87 94.4 (.9) (.7) (23.9) (17.7) (9.1) (2.7) UFI Gel 99.3 98.5 96.9 54.4 92.1 83.9 (1.3) (1.1) (4.1) (47.1) (7.8) (6.0) Tabelle 1: Reduktion an viabler Candida albicans im Verältnis zur Kontrollbehandlung (in %)
Schlussfolgerungen
Weichbleibende Unterfütterungsmaterialien zeigen nur geringe Unterschiede in der Adhäsion von Candida albi- cans sowie ihrer Reinigungsfähigkeit, was klinisch auf eine ähnliche Plaqueanlagerung der Materialien schließen lässt.
Korrespondenzanschrift Dr. Sebastian Hahnel
Universitätsklinikum Regensburg Poliklinik für Zahnärztliche Prothetik Franz-Josef-Strauß-Allee 11
93042 Regensburg Deutschland
B l O m a t e r i a l i e n 1 1 (November), 2010
ABSTRACTS
MBV 06
*S. Grade, A. Winkel, P. Wagener, S. Barcikowski, M. Stiesch
Antibakterielle Wirksamkeit von lasergenerierten Silbernanopartikeln
Die Bildung von bakteriellen Biofilmen auf medizini- schen Implantaten fuhrt häufig zu Komplikationen in Folge einer Infektion des umgebenden Gewebes und ei- nem anschließenden Funktions- bzw. Implantatverlust, welcher eine erhebliche Belastung für den Patienten be- deutet. Biofilme zeigen sich gegenüber konventionellen antibakteriellen Therapien resistent, sodass die Suche nach innovativen Strategien zur Bekämpfung von Bio- filmen in den letzten Jahren große Bedeutung gewonnen hat.
Im Fokus dieser Entwicklung steht u.a. die Verwendung von metallischen Nanopartikeln, welche in wässriger Umgebung Metallionen mit antibakterieller Wirkung freisetzen. Dabei haben sich Silbernanopartikel als be- sonders wirksam gegenüber verschiedenen bakteriellen Krankheitserregern erwiesen.. Die chemische Synthese solcher Nanopartikel beinhaltet allerdings die Verwen- dung toxischer Edukte und Stabilisatoren, welche die Biokompatibilität beeinträchtigen und aufwendige Auf- arbeitungschritte nachsichziehen. Alternativ hierzu kön- nen durch Laserabtrag in Lösung hochreine Nanoparti- kelkolloide hergestellt werden, welche nicht durch Eduktrückstände oder potentiell toxische Stabilisatoren verunreinigt sind. Solche Kolloide sind aufgrund ihrer Biokompatibilität besonders für die medizinische An- wendung geeignet.
In der vorliegenden Studie wurde der Effekt von reinen Silbernanopartikeln (AgNP) untersucht, die mittels La- serablation in deionisiertem Wasser hergestellt wurden.
Die AgNP wurden in Konzentrationen von 5 bis 75 μg/ml in Müller-Hinton-Agar suspendiert und mit jeweils 100 μ 1 einer Bakteriensuspension von Streptococcus mu- tans, Staphylococcus aureus, Escherichia coli oder Pseu- domonas aeruginosa ausplattiert. Nach einer Inkubati- onszeit von 24 h bei 37°C wurden die koloniebildenden Einheiten (KBE) pro Platte ausgezählt (Abbildung 1).
Die mittels Laserablation hergestellten Silbernanopartikel zeigten eine unterschiedliche Wirkung auf das Wachstum der untersuchten Bakterien Beispielsweise werden E. coli und P. aeruginosa bei einer AgNP-Konzentration von
>20 μg/ml effektiv in ihrem Wachstum gehemmt (Abbil- dung 2). Bei keiner der verwendeten Konzentrationen wurde das Wachstum von S. mutans oder S. aureus redu- ziert.
Mögliche Einflussfaktoren sind neben der verwendeten Konzentration der Nanopartikel, der Aufbau der bakte- riellen Zellmembran (gram-/+), die Umweltbedingungen oder die Interaktionszeit. Weitere Studien sind notwen- dig, um die Mechanismen der selektiven antibakteriellen
Wirkung der untersuchten Nanopartikel weiter aufzuklä- ren.
Anhang 1
Abbildung 1: Escherichia coli Kolonien nach 24 Stunden Kultivierung bei 37 °C auf Müller-Hinton- Agar. (A) Kontrollexperiment ohne Silbernanopar- tikel und (B) der Müller-Hinton-Agar enthält Sil- bernanopartikel in einer Konzentration 20 μg/ml.
Abbildung 2: Die Anzahl der koloniebildenden Einheiten des gram-negative Bakteriums E. coli wird bei einer Konzentration der Silbernanopartikel von 20 μg/ml auf etwa 3% reduziert.
Korrespondenzanschrift Sebastian Grade
Medizinische Hochschule Hannover
Zahnärztliche Prothetik und Biomedizinische Werkstoffkunde
Carl-Neuberg-Str. 1 30625 Hannover Deutschland
i B I O m a t e r i a l i e n 11 (November), 2010
W G V 0 1
*S. Grohmann, H. Rothe, Κ. Liefeith
Coatings composed of Polyelectrolyte Multilayers with varying Elasticity influence the Prolifera- tion and Biological functions of Cells
Introduction
Through the layer by layer adsorption of oppositely charged polyelectrolytes steadily growing multilayer films can be constructed [1]. Especially for applications in the field of implantology natural polyelectrolytes like polypeptides (poly-L-lysine/PLL, poly-L-glutamic ac- id/PGA) and sulphated glycos^amino_,glycans (chon- droitin sulphate/CS) display a high potential due to their wide biocompatibility. However, PEM films composed of the highly swellable polysaccharides tend to display a low stiffness resulting in poor cell adhesion and prolifera- tion [2,3]· We present an approach to rigidify PEM films containing polysaccharides. The rigidified films display a greater potential for cell adhesion and the synthesis of al- kaline phosphatase secreted by osteoblasts.
Results and Discussion
Topographical analysis of (PLL-CS)n films with the number of double layers η ranging from 5 to 25 reveal a drastic change in surface roughness. Starting at 15 double layers a super structure with islets of approximately 15 μπι is observable. These islets further grow and fuse to form patches of up to 50 μπι in diameter. In contrast, (PLL-PGA)n films display a rather homogenous topogra- phy with minor surface roughness. While PLL molecules adopt a mostly beta structural conformation in (PLL- PGA)n films their conformation changes to a random coiled structure in films composed of CS as the polya- nion. Furthermore, the choice of polyanion has a great impact on the Young's modulus of the resulting PEM film with 650 kPa and 0.5 kPa for PGA and CS, respec- tively. Osteoblasts cultured on the soft PEM films con- structed from CS as the polyanion resulted in poor cell adhesion with mainly rounded cells after 4 days. Prolife-
ration and ALP activity were also low after 7 days. How- ever, rigidified PEM films show good cell adhesion with well spread osteoblasts after 4 days. Furthermore, both proliferation and ALP activity were significantly en- hanced after 7 days.
Conclusion
PEM films composed of highly swellable polysaccha- rides were successfully rigidified by a very simple and straight forward strategy. Cell biological investigations clearly demonstrate that rigidified films show superior cell adhesion and spreading after 4 days of culture. Fur- thermore, the stiffened films may possess a great poten- tial for coating both dental and orthopedic implants since the ALP acitivity of osteoblasts cultured on the PEM coatings is significantly enhanced.
Acknowledgement: Financial support from the Deutsche Forschungsgesellschaft is gratefully acknowledged.
Literature
[1] Decher, G. (1997) Science 277(5330): 1232-1237.
[2] Richert, L.. (2004). Biomacromolecules 5, 284-294.
[3] Schneider, A. (2006). Langmuir22, 1193-1200.
Korrespondenzanschrift Steffi Grohmann
Institute for Bioprocessing and Analytical Measurement Techniques (iba e. V.)
Rosenhof
37308 Heilbad Heiligenstadt Deutschland
^ ^ j B I O m a t e r i a l i e n 11 (November), 2010
ABSTRACTS
WGV 02
S. Hossfeld, Η. Hartmann, U. Mittnacht, Η. Oliveira, A.-P. Pego, D. Stoll, B. Schlosshauer, *R. Krastev
siRNA nanoparticles incorporated in polyelectrolyte multilayers for local delivery and controlled release of nanotherapeutics
small interfering RNA (siRNA) specifically inhibits the synthesis of designated target proteins. It can be har- nessed to develop a new class of drugs that interfere with desired disease-causing protein. To allow therapeutic ap- plication of siRNA we produce nanoparticles (NP) ob- tained by complexation of chitosan (CHI) and siRNA.
These particles stabilise the siRNA molecules against en- zymatic degradation and can be used for immobilization and to promote the cellular uptake of siRNA. A suitable active carrier for siRNA can be prepared by incorporation of CHI/siRNA NP in polyelectrolyte (PE) multilayer coatings (PEM). Biodegradable PEM have been explored as coatings for controlled drug release. They are build via consecutive deposition of PE also from natural polymers e.g. hyaluronan (HA) and CHI. These coatings offer the ability to control the location of nanoparticles with na- nometer-scale precision and the amount of incorporated nanotherapeutics can simply be varied by the number of layers.
We aim to use siRNA nanoparticles incorporated in PEMs as a cross sectional technology for the refinement of implants allowing to deliver the siRNA locally and to ensure a controlled release.
Our results show that the CHI/siRNA particles possess high stability analysed by gel retardation assay. The par- ticles are positively charged and have a diameter of ca.
100 nm. The particle size and charge increase with in- crease of the ratio of nitrogen to phosphorus (N:P ratio).
PEM were prepared from HA/CHI and contain CHI/siRNA particles. The build up was analyzed by quartz crystall microbalance (QCM) and fluorescence
measurement. The release kinetics of siRNA from the PEM in different media was determined by fluorescence measurement. In cell culture medium PEM containing nanoparticles show low cytotoxicity. The cellular uptake of the nanoparticles resulted in a homogenous distribu- tion in the cell cytoplasm analysed by fluorescence mi- croscopy.
Our results highlight that CHI is successfully used for stabilization of siRNA. The particles incorporated in PEMs are an innovative drug delivery tool allowing bio- logical fictionalization of structural implants with con- trolled and sustained release, lower toxicity, and better patient convenience over conventional formulations. We aim to use this procedure in the future for biological re- finement of implants as a cross-sectional technology, to bind siRNA as a bioactive molecule to a variety of medi- cal implants and thereby to foster clinical therapy and re- generation.
Part of this work was financed by BMBF 13N10023ff, Germany.
Korrespondenzanschrift Dr. Rumen Krastev
NM1 Naturwissenschaftliches und Medizinisches Institut an der Universität Tübingen
Biomaterielien Markwiessenstr. 55 72770 Reutlingen Deutschland
BlOmaterialien 1 1 ( N o v e m b e r ) , 2 0 1 0
W G V 0 3
*S. Franz, I. Forstreuter, V. Hintze, S. Möller, D. Scharnweber, M. Schnabelrauch, J.C. Simon
Immunoregulatory effects of biomaterials modified by artificial extracellular matrices
Various strategies have been developed to modify bioma- terials by engineering immunomodulating surfaces. One strategy is the use of extracellular matrix (ECM) compo- nents as coating for implants. ECM influences migration, adhesion and response of immune and tissue cells. The goal of biomaterial coating with artificial ECM (aECM) is to improve biocompatibility of implants and to accele- rate wound healing by creating a natural environment for the host cells.
Question
In the present study we address the immunomodulatory effects of aECM that was generated utilizing the natural self-assembly potential of collagen I in combination with various glycosaminoglycans (GAGs). As dendritic cells (DC) are key regulators of innate and adaptive immune responses we present data on DC responses resulting from interactions with aECM.
Methods
Monocyte-derived immature DC (iDC) were cultured on either aECM or collagen matrices without GAGs. After 24 h the DC phenotype was assessed by analyzing ex- pression of DC maturation markers, cytokine profile and allostimulatory ability in a mixed lymphocyte reaction.
Results
We find that collagen matrices provoke DC maturation.
Culture of iDC on collagen induces up-regulation of
MHC molecules and co-stimulatory molecules (CD80, CD83, CD86) and release of TNFct and IL-12p40, signals through which DC drive T-cell response. Of note is that aECMs containing GAGs attenuate the collagen driven DC maturation. Inflammatory cytokine release and ex- pression of maturation marker is significantly down- regulated following DC interaction with aECM. Moreo- ver, DC maturation induced by LPS, a potent activator of DC, is also diminished in the presence of aECM as seen by reduced expression of M H C and CD83 and decreased secretion of IL-6 and IL-12p40. Dendritic cells that have been prevented to mature are prone to develop a tolero- genic phenotype suggesting aECM to favor an immuno- supressive DC response.
Conclusion
Our data clearly demonstrate the immunoregulatory ca- pacities of aECM. Coating with aECM therefore represents a novel powerful tool in the design of immu- nomodulating biomaterials.
Korrespondenzanschrift Dr. Sandra Franz
Universität Leipzig
Klinik f. Dermatologie, Venerologie und Allergologie Johannisallee 30
04103 Leipzig Deutschland
B l O m a t e r i a l i e n 11 (November), 2010
ABSTRACTS
WGV 04
*J. Storsberg, K. Kobuch, G.I.W. Duncker, S. Sei
Die Grenzfläche entscheidet - Entwicklung einer bioaktiven-biomimetischen künstlichen Augen- hornhaut (Keratoprothese)
Fragestellung
Entwicklung einer biointegrierbaren, stabilen Keratopro- these aus einem hydrophoben Basismaterial mit polymer- chemischer mit polymerchemischer Grenzflä- chen.Modifikation zur epicornealen Implantation.
Methoden
Hydrophobe, Polymermaterialien wurden mittels nano- technologischer Methoden selektiv im Bereich der Haptik (anterior und posterior) sowie im optischen Bereich (an- terior) polymerchemisch selektiv modifiziert. Diese er- folgte durch eine Kombination von Plasmaaktivierung und dem Auftragen von Polyelektrolytmultischichten in Kombination mit RGD-Sequenzen enthaltenden Protei- nen im Bereich der in das Gewebe zu integrierenden Im- plantathaptik sowie die Bildung von interpenetrierenden Polymerhydrogelnetzwerken an der Grenzfläche des op- tischen Keratoprothesenteils anterior Nach Überprüfung der modifizierten Implkantate in vitro mit cornealen Epi- thelzellen (Schwein) auf die gewünschte Funktionalität und Biokompatibilität wurden diese in vivo in Kanin- chenaugen überprüft. Nach dessen erfolgreicher Überprü- fung wurden die neu entwickelten Keratoprothesen bei ultima ratio Patienten implantiert.
Ergebnisse
Nach einer Beobachtungszeit von 8 Wochen am Kanin- chenauge zeigte sich eine gute Zelladhäsion im Haptikbe- reich und fast vollständige Zellfreiheit im Optikbereich in vivo. Eine Infektion konnte durch regelmässige mikrobio- logische Untersuchungen ausgeschlossen werden. Die Implantation bei ultima ratio Patienten verlief ebenso er- folgreich.
Schlussfolgerung
Durch polymerchemische Modifikation konnte eine Ke- ratoprothese mit funktionalen Grenzflächen mit ge- wünschtem biomimetischen und biointegrierbaren Eigen- schaftsprofil hergestellt und in vivo erfolgreich eingesetzt werden.
Anhang 1
Korrespondenzanschrift Dr. Joachim Storsberg Fraunhofer IAP
Funktionspolymere Medizintechnik Geiselbergstrasse 69
14476 Potsdam-Golm Deutschland
^ Q j B I O m a t e r i a l i e n 11 (November), 2010
W G V 0 5
L. Neelakantan, B. Monchev, E. Kassab, *M. Frotscher, G. Eggeler
Design And Challenges of a Bending Rotation Fatigue Test Rig For In-situ Mechanical And Cor- rosion Testing Of NiTi Shape Memory Alloys
Nickel-Titanium shape memory alloys (NiTi S M A s ) are well known for their unique properties due to the one- way effect or pseudoelasticity. With regard to biomate- rials, NiTi-based alloys can be used for medical devices such as stents, orthodontic archwires, and filters [1], The usage as biomaterial demands good mechanical stability (such as fatigue resistance, large reversible strain, and high tensile strength) and biocompatibility (i.e. non- toxicity and corrosion resistance in a body environment).
The fatigue behaviour of NiTi and NiTi-based alloys has been a topic receiving widespread interest [2], Similarly, its corrosion behaviour has been in the focus of research- ers [3], Even though, these two fronts have been ad- dressed independently, there is only very few work relat- ing the two fields [4, 5], Both fatigue and corrosion are influenced by the surface condition of the alloy. There- fore, it becomes important to study the interplay between these two processes. W e report on the design and fabrica- tion of an in-situ fatigue test rig (bending rotating fatigue (BRF)) with an electrochemical interface for studying the mechanical and electrochemical behaviour simultaneous- ly. The challenges and solutions involved in the layout and design of the in-situ fatigue test rig are reported along with some initial results, depicting the synergetic effect of this new method. In addition, w e discuss the general electrochemical/corrosion behaviour of a binary NiTi and a ternary NiTiCr alloy tested in a simulated body fluid.
Keywords
NiTi shape m e m o r y alloys, pseudoelasticity, bending ro- tation fatigue (BRF), in-situ corrosion testing
References
[1] T. Duerig, A. Pelton, D. Stockei: An overview of ni- tinol medical applications, Mat. Sei. Eng. A 275 (1999),
149-160.
[2] M. Frotscher, J. Burow, M. F.-X. Wagner, P. Schön, Κ. Neuking, R. Böckmann, G. Eggeler: Thermo- mechanical processing, microstructure and bending rota- tion fatigue of ultra-fine grained NiTiCr-wires, Proceed- ings of the International Conference for Shape M e m o r y and Superelastic Technologies ( S M S T 2007), Tsukuba, Japan, A S M International, (2008), 149-158.
[3] S. A. Shabalovskaya: Surface, corrosion and biocom- patibility aspects of Nitinol as an implant material, Bio- Med. Mater. Eng. 12 (2002), 69-109.
[4] C. Hessing, J. Frenzel, M. Pohl, S. Shabalovskaya:
Effect of martensitic transformation on the p e r f o r m a n c e of coated NiTi surfaces, Materials Science and Engineer- ing A 486 (2008), 461-469.
[5] L. Neelakantan, B. Schönberger, G. Eggeler, A. W . Hassel: An in situ tensile tester for studying electrochem- ical repassivation behavior: Fabrication and challenges, Review of Scientific Instruments 81 (2010), 033902.
Korrespondenzanschrift Dr. Lakshman Neelakantan Ruhr University Bochum Institute for Materials Universitätsstraße 150 44801 Bochum Deutschland
B l O m a t e r i a l l e n 11 (November), 2010
ABSTRACTS
WGV 06
*C.K. Müller, Μ. Thorwarth, S. Schultze-Mosgau
Einfluss der Oberflächenrauigkeit auf die Weichgewebeheilung im Bereich der Implantatdurch- trittssteile
Fragestellung
Die Langzeitstabilität dentaler Implantate wird wesent- lich durch den Verlauf der peri-implantären Weichgewe- beheilung beeinflusst. Ziel der vorliegenden, tierexperi- mentellen Studie w a r die Untersuchung des Einflusses der Oberflächenrauigkeit auf die periimplantäre Weich- gewebeheilung.
Methodik
Einen Monat nach Extraktion aller UK-Prämolaren wur- den 12 Minischweinen im Rahmen einer verzögerten So- fortimplantation 4 enossale Dentalimplantate (D: 3.75 m m , L: 13 mm) pro Quadrant inseriert. Jeder Quadrant erhielt 2 zylindrische Schraubenimplantate aus Rcintitan mit hochglanzpolierter (Ra < 0.5 μπι) und 2 mit mikro- strukturierter Schulter (Ra = 1 μιτι). Nach 1, 2, 4 und 12 Wochen transmukosaler linplantatheilung wurden Proben aus dem peri-implantären Weichgewebe entnommen und einer histomorphometrischen Analyse sowie einer pan- genomischen Genexpressionsanalyse zugeführt.
Ergebnisse
A n allen Untersuchungszeitpunkten erbrachte die Leuko- zytenzählung eine signifikant höhere Entzündungsrate im Bereich texturierter Implantatoberflächen. Gene mit Überexpression im Bereich texturierter verglichen mit polierten Implantaten konnten durch funktionelle Analy- se Pathways, wie IL-1 (-log p-value = 3.25),- 2 (-log p-
value = 2.25) und- 6 (-log p-value = 1.90) Signaling, TNF-a-Pathway (-log p-value = 2.00) und V E G F - Signaling (-log p-value = 1.98) zugeordnet werden. Es ergab sich eine bevorzugte Zuordnung überexprimierter Gene zu Funktionen, wie „entzündliche Reaktion (-log ρ
= 4.00) und „Gewebemorphologie - Remodeling extra- zellulärer Matrix (-log ρ = 3.85). Die Expression epithe- lialer Adhäsionsproteine wurde durch die Oberflächen- rauigkeit nicht beeinflusst.
Schlussfolgerungen
Mikrotexturierte Implantatoberflächen im Bereich der Schleimhautdurchtrittsstelle scheinen die epitheliale Ad- häsion nicht zu fordern sondern triggern periimplantäre Entzündungen sowie katabole Prozesse im Bereich der Extrazellulären Matrix. Diese könnten zu einem verstärk- ten krestalen Knochenverlust führen.
Korrespondenzanschrift Cornelia Katharina Müller Universitätsklinikum Jena
Klinik fur Mund-, Kiefer-und Gesichtschirurgie Erlanger Allee 101
07747 Jena Deutschland
I B I O m a t e r i a l i e n 1 1 ( N o v e m b e r ) , 2 0 1 0
H G V 0 1
*J. Klesing, S. Chernousova, A. Kovtun, S. Neumann, L. Ruiz, J.M. Gonzalez-Calbet, M. Vallet-Regi, R. Heumann, M. Epple
Eine injizierbare Paste aus Calciumphosphat-Nanostäbchen zur Transfektion und zur Gen- Stummschaltung
Einführung
Calciumphosphat ist aufgrund seiner hohen Biokompa- tibilität ein wesentlicher Bestandteil fur die Entwicklung neuer Biomaterialien. Ein großes Forschungspotential liegt heutzutage in der Entwicklung von genetisch akti- ven Biomaterialien, die in der Lage sind, Zellprozesse he- rauf oder herab zu regeln. Wir stellen eine Paste als bio- kompatibles Trägersystem für Nukleinsäuren vor und zeigen die Resultate an HeLa und T24-Zellen in vitro.
Material und Methoden
Die Funktionalisierung der Calciumphosphat-Nano- stäbchen wurde mit EGFP-kodierender (enhanced green fluorescent protein) DNA und siRNA (anti-EGFP)
durchgeführt [1,2]. Die Charakterisierung der erhaltenen Dispersion erfolgte mittels Dynamischer Lichtstreuung, Rasterelektronenmikroskopie (REM), Transmissionselek- tronenmikroskopie (TEM), Thermogravimetrie (TG) und Elementaranalyse (ΕΛ).
Die Zellexperimente wurden an T24, HeLa und HeLa- EGFP-Zelllinien durchgeführt [3]. Zur Vitalitätsbestim- mung der transfizierten Zellen wurde ein MTT-Test durchgeführt.
Ergebnisse und Diskussion
Die mit Nukleinsäuren funktionalisierten Calcium- phosphat-Nanostäbchen zeigten in der Dynamischen Lichtstreuung einen monodispersen Charakter ohne Agg- regate und eine kolloidale Stabilität von mehreren Wo- chen. Die Rasterelektronenmikroskopie zeigt stäbchen- förmige Partikel mit einer Länge von 100-200 nm und einer Breite von 25 nm.
Der nanokristalline Charakter konnte mittels T E M erfasst werden. Die Beladung der funktionalisierten Nanostäb- chen mit Nukleinsäuren wurde mittels TG und EA zu et- wa 2-3 % bestimmt.
Die DNA-EGFP-funktionalisierten Calciumphosphat- Nanostäbchen lieferten mit einschaligen Calciumphos- phat-Nanopartikeln vergleichbare Transfektionsraten [4].
Die gene-silencing-Efüz\enz lag bei etwa 20 %. Ein kat- ionisches Transfektionsmittel (Dendrimer) zeigte ver- gleichbare Resultate, wirkte jedoch zelltoxisch.
Eine Aufkonzentration der erhaltenen Dispersion lieferte eine injizierbare Paste als potentiell genetisch aktives Knochenersatzmaterial.
Literatur
[1] V. V. Sokolova, 1. Radtke, R. Heumann, and M. Epp- le, Biomaterials, 2006, 27, 3147.
[2] V. Sokolova, A. Kovtun, O. Prymak, W. Meyer- Zaika, Ε. A. Kubareva, Ε. A. Romanova, T. S. Oretskaya, R. Heumann, and M. Epple, J. Mater. Chem., 2007, 17, 721.
[3] J. Klesing, S. Chernousova, A. Kovtun, S. Neumann, L. Ruiz, J. M. Gonzalez-Calbet, M. Vallet-Regi, R. Heu- mann, M. Epple, J. Mater. Chem. (in press).
[4] T. Welzel, I. Radtke, W. Meyer-Zaika, R. Heumann, and M. Epple, J. Mater. Chem., 2004, 14, 2213.
Korrespondenzanschrift Jan Klesing
Universität Duisburg-Essen Anorganische Chemie Universitätsstr. 7 45141 Essen Deutschland
Abb. 1: REM-Aufnahmen von unfunktionalisierten Nano- stäbchen (links) und von DNA- funktionalisierten Nano- stäbchen (rechts).
~y 1 B l O m a t e r i a l i e n n (November), 2010
ABSTRACTS
HGV 02
*M. Gelinsky, R. Dittrich, A. Bernhardt, S. Mani, S. Shenoy, A. John, F. Despang
Neuartige Calciumphosphat-Biokeramiken mit kanalförmigen, parallel ausgerichteten Poren für den Knochenersatz
Knochengewebe ist ein hochgradig anisotropes Material.
Während der spongiöse Knochen aus den Knochenbälk- chen (Trabekeln) gebildet wird, ist die vorherrschende Struktur des kortikalen (kompakten) Knochens die der Osteone. Bei den Osteonen handelt es sich um die von Osteoblasten aufgefüllten Resorptionskanäle, welche im Zuge der Knochen-Remodellierung von Osteoklasten er- zeugt wurden. Diese Resorptionskanäle - und damit die Osteone - verlaufen immer parallel zur langen Achse der Röhrenknochen. Durch Anwendung der Methode der ge- richteten ionotropen Gelbildung von Alginat-basierten Kompositmaterialien ist es uns gelungen, Calciumphos- phat-Biokeramiken zu erzeugen, welche die anisotrope Osteonen-Struktur des kompakten Knochens imitieren.
Durch gerichtetes Eindiffundieren von Calciumionen in Hydroxylapatit-haltige Alginat-Sole können Verbund- werkstoffe mit parallel orientierten, kanalförmigen Poren erzeugt werden [1], Durch Ausbrennen der Biopolymer- phase entstehen reine Calciumphosphat-Biokeramiken, wobei die anisotrope Porenstruktur vollständig erhalten bleibt [2], Die so erzeugten Materialien wurden einge- hend materialwissenschaftlich und physiko-chemisch charakterisiert, wobei die Eigenschaften über die Zu- sammensetzung und das gewählte Temperaturregime in weiten Grenzen eingestellt werden können. In Zellkultur- experimenten mit humanen mesenchymalen Stammzellen (hMSC) wurde die Biokompatibilität in vitro nachgewie- sen sowie das Zellverhalten untersucht. Im Rahmen einer Pilotstudie wurde durch Implantation in einen rein korti- kalen Knochendefekt im Kaninchenfemur das Verhalten in vivo untersucht, wobei die Porenkanäle längs zur Kno- chenachse orientiert wurden.
Durch Ausbrennen der Alginat-Phase bei 650°C entste- hen nanokristalline Hydroxylapatit-Biokeramiken (Braunkörper), deren Kanalporen je nach Versuchsbedin- gungen Durchmesser zwischen ca. 50-150 μηι aufweisen.
Die Druckfestigkeit liegt im Bereich von 4,5 MPa und die Spaltzugfestigkeit (ermittelt durch den Brazil-Test) erreicht Werte von ca. 500 kPa. In Besiedlungsexperi- menten mit hMSC konnte zwar mit ca. 10% nur eine ge- ringe Besiedlungseffizienz erreicht werden; einmal adhä- rent gewordene Zellen proliferierten dann aber konti- nuierlich über einen Zeitraum von 28 Tagen. Bei Zusatz von osteogenen Differenzierungszusätzen wurde ein Ans- tieg der spezifischen Aktivität des Markerenzyms Alkali- sche Phosphatase (ALP) mit einem typischen Maximum am Tag 14 beobachtet werden. Implantation der Bioke- ramiken in einen rein kortikalen Defekt im Kaninchen- femur führte zu einer raschen Knochen-Integration und zum Einwachsen von Gewebe in die kanalförmigen Po- ren. Zu dieser günstigen Gewebereaktion mag die nano- kristalline Oberflächenstruktur der nicht-gesinterten Cal- ciumphosphat-Biokeramiken beigetragen haben, welche jener des Knochens selbst nahekommt.
[1] R. Dittrich, F. Despang, A. Bernhardt, Th. Hanke, G.
Tomandl, W. Pompe, M. Gelinsky: Scaffolds for hard tis- sue engineering by ionotropic gelation of alginate - influ- ence of selected preparation parameters. J. Am. Ceram.
Soc. 2007, 90, 1703-1708.
[2] F. Despang, R. Dittrich, A. Bernhardt, T. Hanke, G.
Tomandl, M. Gelinsky: Channel-Like Pores in Hap- Containing Scaffolds for Bone Engineering: Hydrogels vs. Ceramics. Tissue Engin. Part A 2008, 14, 819.
Korrespondenzanschrift Dr. Michael Gelinsky TU Dresden
Max-Bergmann-Zentrum Budapester Str. 27 01069 Dresden Deutschland
BlOmaterialien 11 ( N o v e m b e r ) , 2 0 1 0