Jahrestagung der
Deutschen Gesellschaft für Biomaterialien (DGBM) 2005 Funktionalisierte Biomaterialien
Würzburg, 7. bis 8. Oktober 2005
Fr.-W. Bach, Th. Hassel
Herstellung und Deformationsanalyse zur Qualifizierung einer Schutzschicht aus Magnesiumfluorid zur gesteuerten Degradation von Implantatlegierungen auf Magnesiumbasis
Creation and deformation analysis for qualification of a protecting surface layer made of magnesium fluoride to control the degradation of implantable magnesium base alloys
Einleitung
Magnesium stellt als bioresorbierbares Material einen Werkstoff dar, welcher die vorteilhaften mechanischen Eigenschaften der Metalle mit den Anforderungen an die Biokompatibilität hervorragend kombiniert. Um Magnesiumlegierungen als kardiovaskulären Stent einsetzen zu können, ist es erforderlich die Degradation des Materials zu steuern, da das Implantat in der ersten Phase nach der Implantation die Stützfunktion des Gefäßes übernehmen muss. Erst nach der Endothelialisierung im Gefäß darf die Degradation und damit der Verlust der mechanischen Stabilität beginnen.
Um einen solchen Degradationsverlauf zu bewirken, wird eine Magnesiumfluoridschicht auf die Oberfläche des Implantates aufgebracht, welche eine temporäre Schutzschicht für den Grundwerkstoff darstellt. Die Qualität der Schichten während der Verformung wird mittels Vier-Punkt-Biegeversuch kombiniert mit einer elektrochemischen Messung bestimmt [2].
Material und Methoden
Als Grundmaterialien werden Mg (rein), MgCa0,8 und MgMn1 verwendet. Aus stranggepresstem Vormaterial werden polierte Biegestäbchen hergestellt. Der Beschichtungsprozess erfolgt durch das Kochen in NaOH-Lösung und anschließendem Tauchen in HF (40
%ig). Die Schichtbildung basiert auf der Bildung einer Mg(OH)2-Schicht, welche anschließend zu MgF2
umgesetzt wird. Die Proben werden in einen Elektrolytbehälter eingeklebt, so dass nur der Zugspannungsbereich während der Biegung mit einer NaCl-Lösung benetzt wird. Basis der Messung ist der vorhandene Ruhepotenzialunterschied zwischen beschichtetem und nicht beschichtetem Zustand. Es wird eine Dreielektrodenzelle mit einem Potentiostaten (Wenking MP81) verwendet. Das Ruhepotenzial RPwird eingestellt und fixiert. Anschließend wird ein Vier- Punkt-Biegeversuch durchgeführt [1].
Ergebnisse
Durch den Beschichtungsprozess können unterschiedlich dicke Schichten (1-5µm) erzeugt werden. Dabei ist die Schichtbildung nur von der Vorbehandlung der Proben (Kochen in NaOH-Lsg.) abhängig (Abb. 1). Wird die Probe durch die Vier-Punkt-Biegung (Instron MPM;
200kN) verformt, bilden sich im Zugspannungsbereich innerhalb der elektrochemischen Zelle Risse. Damit verschiebt sich das RP um zirka -60mV, was einen Regelstrom des Potetiostaten induziert, um auf das fest eingestellte Potenzial zurückzuregeln. Dieser Regelstrom wird korreliert mit dem Kraftverlauf und dem Kolbenweg ausgewertet (Abb. 2). Der Stopp der
0 1 2 3 4 5
0 1 2 3 4
Zeit [h]
Schichtdicke[µm]
Mg (99,8%) + MgF2 MgCa0,8 + MgF2 M1 + MgF2
Abb. 1: Schichtdicke in Abhängigkeit von der Vorbehandlung (Kochen in NaOH)
-100 0 100 200 300 400 500 600 700
0 100 200 300 400
Zeit [s]
Kraft[N]
-1 0 1 2 3 4 5
Kolbenweg[mm]/ Zellstrom[5*mA]
Zellstrom Kraft
Kolbenweg
Abb. 2: Repassivierung der Oberfläche nach plastischer Verformung einer MgF2-besch. MgCa0,8 Biegeprobe Diskussion
Die Ergebnisse zeigen für alle untersuchten Werkstoffe, dass die aufgebrachten Schichten bei einer Verformung aufreißen, aber durch die Repassivierung der Oberfläche kein verstärkter Korrosionsangriff an diesen Stellen zu erwarten ist. Zu erklären ist dieser Effekt durch die natürliche Mg(OH)2 Bildung im Rissgrund, welche die Oberfläche wieder elektrochemisch abschirmt. Damit ist das ausgewählte Schichtsystem für die angestrebte Anwendung am Mg-Stent geeignet.
Literatur
[1] Th. Hassel; F.-W. Bach; C. Krause; P. Wilk:
Corrosion protection and repassivation after the deformation of magnesium alloys coated with a protective magnesium fluoride layer. TMS Mg- Techn.2005 (SF/USA); 13-17.Feb.: Seite 485-490, 2005 [2] R. Thull, F. Macionczyk: Bestimmung der Rissfestigkeit passivierbarer Implantatoberflächen.
Biomedizinische Technik, 47: Seite 310-314, 2002 Korrespondenzanschrift
Dipl.-Ing. Thomas Hassel
Institut für Werkstoffkunde; Universität Hannover
Fr.-W. Bach, Th. Hassel, D. Bormann, R. Kucharski
Elektrochemisch induzierte Abscheidung von Calciumphosphat auf der Oberfläche von kompakten und zellularen Strukturen aus Magnesiumlegierungen
Electrochemical induced deposition of calcium phosphate on the surface of compact and cellular structures made from magnesium alloys
Einleitung
Die knöcherne Integration von Implantaten durch die Aufbringung von Calciumphosphatschichten auf der Oberfläche ist eine verbreitete Methode um Dauerimplantate an den Implantationsort anzubinden.
Die Beschichtung von degradablen Mg-Werkstoffen mit derartigen Schichten soll bei temporären Knochen- implantaten (Platten, Schwämme etc.) zu einer schnelleren Anbindung und Durchwachsung des Knochens führen. Hierzu wird ein Verfahren vorgestellt, durch welches das korrosionsanfällige Magnesium in sauren Elektrolyten mit Calciumphosphat beschichtet werden kann.
Material und Methode
Stranggepresste Magnesiumstifte (Mg rein) sowie zellulare Magnesiumschwämme (AM50) werden als Arbeitselektrode (AE) in eine galvanostatisch geschaltete galvanische Zelle eingebracht. Der Zellstrom wird so gewählt, dass an der AE eine Elektrolyse des Wassers stattfindet. Die zwei verwendeten Elektrolytlösungen (1. CaH4P2O8x 2H20 ges. pH=2,8;
2. Ca(NO3)2x 4H2O + NH4H2PO4 pH=4,0) werden bei einer Temperatur von 40 °C zur Beschichtung genutzt.
Der Prozess beruht auf der Änderung der Löslichkeit bei variierendem pH-Wert. Die Zersetzung des Wassers an der Mg-Oberfläche führt zu einer sehr starken Erhöhung des pH-Wertes an der Oberfläche, was zur Überschreitung des Löslichkeitsproduktes von Calciumphosphat führt. Die Ca/P-Phase fällt aus und haftet an der Probe oberflächlich an. Es wird der Einfluss unterschiedlicher Ca/P–Verhältnisse im Elektrolyten, das Anlegen verschiedener Zellströme und unterschiedliche Beschichtungszeiten auf die Schichtbildung untersucht.
Ergebnisse
Abbildung 1 zeigt die Beschichtungsresultate an einem Mg-Stift und an einem AM50-Schwamm (Zylinder W=8, h=10). Die Stifte zeigen sehr homogene Schichten an der Oberfläche.
Abb.1: Unbeschichteter Rohling (l), beschichteter Stift (m) und beschichteter Schwamm (r).
Die mittels eines MicroCT80 (Scanco Medical) untersuchten Schwämme zeigen eine Beschichtung mit Ca-P in den äußeren Bereichen. Die inneren Poren
konnten durch die Wasserstoffentwicklung während des Prozesses und des mangelhaften Abtransportes aus den Poren nur unzureichend beschichtet werden. Die Zugabe von Ethanol zum Elektrolyten erhöht hierbei die Schichthaftung und führt zu homogenen Schichten an den Oberflächen. Für unterschiedliche Beschichtungs- zeiten zeigt Abbildung 2 den Aufbau an Calciumphosphat an der Oberfläche der Stifte. Bei sehr langen Beschichtungszeiten können jedoch keine kratzfesten Schichten großer Dicke aufgebracht werden.
1,00E-05 1,00E-04 1,00E-03 1,00E-02 1,00E-01
1 10 100 1000 10000 100000
Zeit [s]
normierte Depositmasse[g/cm2 ]
Abb. 2: Depositmasse in Abhängigkeit zur Beschichtungsdauer.
Diskussion
REM-Untersuchungen zeigen, dass der Schichtaufbau durch ein Aufwachsen von stengel- und plattenförmigen Kristalliten erfolgt. Abbildung 3 zeigt für 10 Sekunden und 20 Minuten die jeweilige Belegung der Oberfläche mit Calciumphosphat. Untersuchungen der Phasenzu- sammensetzung am Röntgendiffraktometer (XRD) ergeben die Bildung von Calciumhydrogenphosphat (Brushit) als Hauptbestandteil des Schichtmaterials. Bei der Steigerung des Ca/P – Verhältnisses J 1,67 ist Hydroxylapatit innerhalb der abgeschiedenen Masse nachweisbar. Der Einsatz von bis zu 50 % Ethanol als Elektrolytzugabe verbessert das Ergebnis wesentlich, da das Beschichtungsmaterial homogener an der Oberfläche aufwächst. Die Beschichtung zellularer Strukturen ist prinzipiell möglich, sofern sie offenporig sind und ein gutes Ausgasverhalten des durch die Elektrolyse entstehenden Wasserstoffs zeigen.
100 µm 100 µm 100 µm
100 µm 100 µm100 µm100 µm100 µm
Abb. 3: links 10s besch.; rechts 20min besch. Mg – Stift Korrespondenzanschrift
Dipl.-Ing. Thomas Hassel
Institut für Werkstoffkunde; Universität Hannover Schönebecker Allee 2
30823 Garbsen
Fr.-W. Bach, Th. Hassel, A. Golovko, Ch. Hackenbroich, A. Meyer-Lindenberg
Resorbierbare Implantate aus Magnesium durch Mikrolegieren mit Calcium, deren Verarbeitung und Eigenschaften.
Absorbable implants made from Magnesium by micro alloying with calcium, their processing and properties.
Einleitung
Da während der Stentdilatation große plastische Verformungen realisiert werden müssen, werden zum einen sehr hohe Anforderungen an die Herstellung von degradablen Stents gestellt. Zum anderen sollen die Abbauprodukte während der Resorption keine Irritationen am Implantationsort hervorrufen. Aus diesem Grund wird eine Legierung entwickelt, welche bei minimalem Gehalt an Legierungselementen bereits ausreichende mechanische Eigenschaften und eine moderate Abbaurate besitzt. Hierzu wurde die Herstellbarkeit von filigranen Röhrchen als Stentgrundkörper aus einer mikrolegierten Mg-Ca- Legierung über einen kombinierten Strangpress- und Ziehprozess untersucht.
Material und Methoden
In einem Vakuumofen wird eine Mg-Legierung mit einem Ca–Gehalt von 0,8 Masse% erschmolzen. Zur Validierung der Biokompatibilität dieser Legierung, wurden am Kaninchenmodell in vivo Studien von 3-6 Monaten durchgeführt, wobei das Material in Stabform intramedullär in beide Tibiae von 10 Tieren implantiert wurde. Verarbeitet wird das Material durch Hohl- Vorwärts-Strangpressen ohne Schale über einen mitlaufenden Dorn zu einem dünnen Röhrchen mit einem Durchmesser von 6,4mm und einer Wandstärke von 400µm. Die weitere Bearbeitung zu filigranen Röhrchen erfolgt über Hohlgleitziehvorgänge zur Verringerung des Außendurchmessers sowie anschließendem, mehrmaligen Abstreckgleitziehen über einen Kerndraht zur Verringerung der Wandstärke.
Ergebnisse
Gefügeuntersuchungen ergeben, dass durch das Strangpressen eine Kornfeinung (Korngröße @ 20µm) erreicht wird. Die verschiedenen Ziehdurchgänge verfeinern das Korn nicht mehr wesentlich (Abb. 1), führen aber zur Ausbildung eines isotropen, von der Strangpressrichtung unabhängigen Gefüges.
Strangpressen Rohrziehen
0 10 20 30 40 50 60
0 1 2 3 4 5
Umformschritte
Korngröße[µm]
30µm 30µm 30µm
30µm
30µm
Strangpressen Rohrziehen
0 10 20 30 40 50 60
0 1 2 3 4 5
Umformschritte
Korngröße[µm]
Strangpressen Rohrziehen
0 10 20 30 40 50 60
0 1 2 3 4 5
Umformschritte
Korngröße[µm]
30µm 30µm 30µm
30µm
30µm 30µm
30µm 30µm30µm 30µm30µm
30µm 30µm
30µm 30µm
Abb.1: Korngröße in Abhängigkeit vom Umformschritt
0 100 200 300 400
0 5 10 15 20
Dehnung [%]
Spannung[MPa]
6,4 mm 5,8 mm 5,3 mm 4,4 mm 3,65 mm 3,2 mm 2,9 mm
Abb.2: Mechanische Eigenschaften von dünnen Röhrchen im Herstellungsprozess (W- Reduktion).
Im Tierversuch zeigt MgCa0,8 ein sehr positives Verhalten mit einer unkritischen Abbaurate. Während der gesamten Versuchsdauer war weder klinisch noch röntgenologisch eine Gasentwicklung nachweisbar.
Sowohl endostal als auch periostal war im Bereich der Implantate eine Knochenzubildung zu beobachten. Im REM waren auf den explantierten Stiften Zelladhäsionen zu erkennen.
Diskussion
Für den Einsatz von Mg-Werkstoffen ist eine zeitlich gesteuerte Degradation notwendig. Durch die Entwicklung einer MgCa0,8–Legierung und der Erarbeitung einer Prozesskette zur Herstellung von Stentgrundkörpern (Abb.3) wird die Möglichkeit aufgezeigt, bioresorbierbare Stents auf Mg–Basis herzustellen. Die mechanischen Eigenschaften können durch Wärmebehandlungsschritte noch optimiert werden, so dass Dehnungen bis zu 20% erreichbar sind.
Mit Korngrößen @ 20µm sind über den Strutquerschnitt von ca. 200µm genügend Körner vorhanden, dass eine ausreichende Verformung während der Dilatation erreichbar ist.
Prozesskette RohrSG
W 4,6W
Ziehen ohne Kerndraht (Dorn) Ziehen mit Kerndraht (Ziehen mit langem Dorn) W
6,4W WW
5,3 WW
4,0 WW 3,4 WW
2,9 WW
W 2,5
2,6W WW
2,4 WW 2,4 WW
2,3 WW 2,2 WW
2,1 WW 1,9 WS=0,2 Prozesskette
RohrSG W 4,6W
Ziehen ohne Kerndraht (Dorn) Ziehen mit Kerndraht (Ziehen mit langem Dorn) W
6,4W WW
5,3 WW
4,0 WW 3,4 WW
2,9 WW
W 2,5
2,6W WW
2,4 WW 2,4 WW
2,3 WW 2,2 WW
2,1 WW 1,9 WS=0,2
Abb.3: Prozesskette zur Herstellung von Stentgrundkörpern aus der Legierung MgCa0,8.
Nach der Herstellung der Röhrchen können diese direkt durch Laserschneiden strukturiert werden und den weiteren Polier- und Beschichtungsprozessen zugeführt werden. Die bisherigen Untersuchungen zeigen, dass die gewählte Legierung den Anforderungen an die Biokompatibilität genügt und für den Einsatz als kardiovaskulärer Stent sowie als Knochenimplantat ausreichende mechanische Eigenschaften aufweist.
Korrespondenzanschrift Dipl.-Ing. Thomas Hassel
U. Beck, R. Lange, H.-G. Neumann
Erzeugung von Nano-Strukturen an Titanoberflächen durch Mikroplasma-Verfahren Nanostructures on Ti- surfaces produced by micro-plasma
Einleitung
Titan und seine Legierungen sind bevorzugte Materialien für stark belastete Implantate in den Bereichen Zahn- prothetik, Knochensynthese und Orthopädie. Dabei spielt der Oberflächenzustand der Implantate eine we- sentliche Rolle. Er wirkt regulierend auf die Reaktion des Knochens und somit auf die Art und Intensität der Verankerung des Implantats. Dieser Sachverhalt hat die Implantathersteller zu einem Umdenken veranlasst.
Während in der Vergangenheit Implantate mit einem Standard-Oberflächen-Finishing versehen wurden, fin- den heute zahlreiche neue Verfahren zur differenzierten Oberflächenbehandlung Anwendung. Eines davon – das Mikroplasma-Verfahren – ist ein kostengünstiger und umweltverträglicher Prozess, mit dem die Topographie und Chemie von Implantatoberflächen modifiziert wer- den kann. Diese Technik wird bislang eingesetzt, um Implantatoberflächen mit Deckschichten zu versehen oder auch, um sie zu polieren [1, 2].
Das Anliegen in der vorliegenden Arbeit war es, ein Mikroplasma-Verfahren zu nutzen, um die Oberflächen von Titanimplantaten mit einer möglichst gleichmäßi- gen, deckschichtfreien Nanostruktur zu versehen. Dabei wurden die Einflüsse der Ausgangsstruktur der Oberflä- chen und der elektrischen Parameter des Plasmaprozes- ses auf die erzeugte Struktur untersucht.
Material und Methoden
Als Substrat wurden Proben aus handelsüblich reinem Titan genutzt. Die Probenoberflächen sind unterschied- lich strukturiert worden (Nassschliff mit 4000er Schleif- papier; Nassschliff mit 80er Schleifpapier; Partikel- strahlen mit Glaskugeln). Die Strukturierung der Ober- flächen durch den Mikroplasma-Prozess wurde in einem Bad mit Elektrolytlösung durchgeführt. Der Elektrolyt bestand aus deionisiertem Wasser, in dem Natriumflou- rid (1…8g/l) und Natriumcarbonat (0,1…1g/l) gelöst waren. Durch das Anlegen einer gepulsten Gleichspan- nung entstand an der Grenzfläche zwischen der Titan- probe und der Elektrolytlösung ein dünner Wasser- dampffilm, in dem durch Funkenentladung Mikroplas- men erzeugt wurden. Um die angestrebten Oberflächen- strukturen zu erzielen, wurde mit Spannungen im Be- reich von 450V bis 650V experimentiert. Die Prozess- dauer lag zwischen einer und zehn Minuten.
Die durch das Mikroplasma-Verfahren strukturierten Ti- Oberflächen wurden optisch mittels REM (S360, Cam- bridge, GB und Quanta 400, FEI, USA) und elektroche- misch durch OCP-, LSV-, CA- und EIS-Messungen (100µHz…100kHz) charakterisiert. Die elektrochemi- schen Messungen wurden mit einem AUTOLAB System (ECO Chemie, Niederland) und einem IM6e (ZAHNER, Deutschland) durchgeführt. Alle elektrochemischen Messungen erfolgten mit drei-Elektroden-Technik in Phosphat gepufferter Kochsalzlösung (PBS) bei pH 7,2.
Ergebnisse und Diskussion
Während die EIS-Phasenspektren der Ausgangsstruktu- ren der Ti-Oberflächen nur ein Maximum aufwiesen, zeigten die Spektren der durch das Mikroplasma er- zeugten Endstrukturen deutlich ein zweites Maximum, das auf eine Deckschicht hinwies (Abb. 1). Diese Deck- schicht erwies sich als poröse und – bei hinreichender Dicke von zirka 2µm – leicht zu entfernende Ti-Oxid- Schicht, die eine Vergrößerung der realen Oberfläche um mehr als eine Größenordnung erzeugte. Die Oberfläche der Oxidschicht als auch die darunter liegende – eigent- lich interessierende – Metalloberfläche wiesen eine rela- tiv gleichmäßige, nanoskalierte Feinstruktur auf (Abb.
2), die nur wenig durch die Ausgangsstruktur bzw. die elektrischen Prozessparameter beeinflusst wurde.
1,E+00 1,E+01 1,E+02 1,E+03 1,E+04 1,E+05 1,E+06 1,E+07
1,E-03 1,E-01 1,E+01 1,E+03 1,E+05 f [Hz]
|Z| [Ohm]
0 10 20 30 40 50 60 70 80 -phase [¡] 90 plasma treated without oxide layer
Abb. 1: Typische EIS-Spektren plasmabehandelter Ti- Proben (voll – Betrag, leer – Phase) mit (Rechtecke) und ohne (Dreiecke) Oxiddeckschicht
Abb. 2: REM-Aufnahmen plasmabehandelter Ti-Proben – links: mit Oxiddeckschicht, rechts: ohne Deckschicht (5µm-Balken jeweils links unten)
Literatur
[1] Meletis E. I., Wang F. L., Jiang J. C.: Surf. Coat.
Technol., 150, 2-3 (2002) 246
[2] Nevyantseva R. R., Gorbatkov S. A., Parfenov E. V., Bybin A. A.: Surf. Coat. Technol., 148,01 (2001) 30
Korrespondenzanschrift
Ulrich Beck, Universität Rostock, IEF, Inst. GS 18051 Rostock, Germany; ulrich.beck@uni-rostock.de
St. Berger, M. Schnabelrauch
Entwicklung eines Batch-Verfahrens für nanopartikulären Carbonat-Apatit Development of a batch process for nano-particulated carbonate apatite
Einleitung
Nanopartikuläre Apatite haben in jüngster Zeit als Bio- materialien für die Knochenregeneration wachsende Aufmerksamkeit gefunden. Als Vorbild dieser biomime- tisch abgeleiteten Materialien dient der, die mineralische Phase des Knochens bildende und in nanokristalliner Form vorliegende, Calcium-defiziente Carbonat-Apatit.
Vorteile, die man sich von nanopartikulärem CAP (nano- CAP), verglichen mit nanopartikulärem Hydroxylapatit (HA) verspricht, sind eine schnellere Resorption im Organismus sowie eine verbesserte Cytokompatibilität.
Ein Problem bei der Herstellung nanopartikulärer Apa- tite durch nasschemische Fällungsverfahren liegt in der Erzielung befriedigender Raum-Zeit-Ausbeuten.
Im vorliegenden Beitrag beschreiben wir ein einfaches und up-scale-fähiges Batch-Verfahren zur Herstellung von nano-CAP.
Materialien und Methoden
Die Herstellung von nano-CAP erfolgte im 2l-Reaktions- gefäß durch eine konventionelle Fällungsreaktion ausge- hend von wäßrigen Lösungen von Calciumhydroxid, Natriumhydrogencarbonat und Phosphorsäure bei pH 10 und 50 °C. Nach 12 h Rühren wurde das Reaktionspro- dukt mehrfach mit destilliertem Wasser gewaschen und bei 4600 U/min zentrifugiert, bis pH 7 erreicht wurde.
Das nano-CAP wurde bei 70 °C 12 h getrocknet.
Zur Untersuchung der Kristallstruktur diente ein Sie- mens D5000 Röntgendiffraktometer (Cu K Strahlung).
FT-IR Messungen wurden mit einem Bio-Rad FTS 175 Spektrometer (KBr-Technik) durchgeführt und zur Par- tikelgrößenbestimmung kam ein Feldemissions-Raster- elektronenmikroskop SUPRA 55VP (Zeiss) zum Einsatz.
Die chemische Zusammensetzung des nano-CAP wur- den mit den üblichen elementaranalytischen Verfahren bestimmt.
Ergebnisse und Diskussion
Es wurde ein diskontinuierliches Verfahren zur Herstel- lung von nano-CAP entwickelt. Bei Verwendung eines 2l-Reaktionsgefäßes lassen sich mit diesem Verfahren pro Batch bis zirka 130 g nano-CAP synthetisieren. Es konnten dabei Carbonat-Gehalte im nano-CAP von bis zu 16 % realisiert werden.
Im FT-IR-Spektrum (Abb. 1) des hergestellten nano- CAP sind die für HA typischen Absorptionsbanden für die Streckschwingung der Hydroxidionen bei 3570 cm-1 sowie für die Streckschwingungen der Phosphationen bei 1040, 963, 603, und 567 cm-1 sichtbar und zusätzlich können zwei weitere Absorptionsbanden um 1450 und 875 cm-1 detektiert werden, die den Carbonationen zuzu- ordnen sind. Abbildung 2 zeigt das Röntgendiffrak-
nokristallinität des CAP. Rasterelektronenmikroskopi- sche Aufnahmen zeigten Partikel mit Abmessungen von 60-150 nm Länge und 30 nm Durchmesser.
Abb. 1: FT-IR Spektrum von hergestelltem nano-CAP.
Abb. 2: Röntgendiffraktogramm von nano-CAP.
Schlussfolgerungen
Die entwickelte Synthesevariante gestattet die einfache Herstellung größerer Mengen an nano-CAP im Batch- Verfahren, wobei eine weitere Maßstabsvergrößerung des Prozesses möglich erscheint. Der Einsatz des erhal- tenen und hinsichtlich Zusammensetzung und Struktur charakterisierten nano-CAP zur Entwicklung neuer Kno- chenersatzmaterialien ist zur Zeit Gegenstand weiterer Untersuchungen.
Literatur
[1] LeGeros R. Z.: Calcium Phosphates in Oral Biology and Medicine. Karger, Basel, 4ff., 1991.
Korrespondenzanschrift Dr. Matthias Schnabelrauch INNOVENT e. V.
Pruessingstrasse 27b D-07745 Jena, Germany
D. Bogdanski, T.A. Schildhauer, M. Epple, G. Muhr, M. Köller
Rolle löslicher Mediatoren bei implantatnaher Zellaktivierung nach Leukozytenadhärenz an Biomaterialien
Role of soluble mediators on peri-implant cell activation after adherence of leukocytes to biomaterials
Introduction
Blood leukocytes belong to the first cells which will immediately get into close contact with implant surfaces.
Physiologically, these cells are necessary for a controlled tissue integration. Additionally, they provide growth factors necessary to initiate and accelerate wound healing, tissue repair and regeneration. Beside tissue remodeling soluble leukocyte mediaters are key signals for host defense and/or inflammatory reactions. Thus, we analyzed leukocyte functions in the presence of leukocyte/biomaterial conditioned media.
Materials and Methods
Conditioned media (CM) were obtained by interactions of leukocytes with implant biomaterial samples for 24 h using cell culture conditions. Following materials (10 mm diameter discs) were tested: polished solid metals (nickel titanium-NiTi, tantalum) or porous metal samples (tantalum, titanium) or calcium phosphate coated NiTi.
Polymorphonuclear neutrophil leukocytes (PMN) and peripheral blood mononuclear cells (PBMC) were isolated from EDTA-anticoagulated peripheral blood.
The influence of CM on leukocyte functions was analyzed (regulation of adhesion molecules, chemotaxis, phagocytosis, apoptosis, bacterial killing) using flow cytometric assay and microbiological assays. The cytokine pattern of respective CMs was analyzed by ELISA and protein array technique.
Results and Discussion
In contrast to CM obtained by polished solid materials, conditioned media obtained by coated or porous materials led to cell cluster formation and upregulation of adhesion molecules (CD11b, CD66, ICAM-1) (see Fig.), to an increase in chemotaxis, to an increase in phagocytosis and to an increase in bacterial killing of freshly isolated leukocytes or whole blood. Cytokine analysis revealed significantly elevated concentrations of IL-1ra, IL-6, IL-8, TNF and GM-CSF of CM obtained from coated/ porous material compared to CM from polished solid materials. In contrast, concentrations of IL-2 or IFN- were not significantly different in both CMs.
Concluding remarks
Our data demonstrate that the interaction of leukocytes with implant material led to the release of soluble mediators (such as cytokines) which may influence functional activities of cells in the peri-implant microenvironment. Among the analyzed cytokines those factors released from myeloid cells (PMN and monocytes within the PBMC) were elevated which
indicates that these cells are predominantly activated during cell surface contact whereas lymphocytes are not activated under these experimental conditions. The material surface topology (e. g. roughness, porosity, total surface area) influences leukocyte mediater generation more than nature of the material. Whether a microenviroment enriched with cytokines from activated leukocytes will also provide an area of enhanced local host defense in-vivo has to be proven by further studies.
Fig. 1: ICAM-1 expression of PBMC cultured for 24 h in the presence of conditioned media obtained after the interaction of PMN with non-coacted (dotted line, MFI 296) or calcium phosphate coated NiTi (solid line MFI 970).
Corresponding author Dipl. Biol. Denise Bogdanski
BG Kliniken Bergmannsheil, Department of Surgery, Surgical Research
Bürkle-de-la-Camp-Platz 1 44789 Bochum, Germany
W. Braun, A. Ewald, R. Thull
Biokompatibel und Bakteriostatisch – Eigenschaften Ca(OH)
2modifizierter Titanoberflächen zur Verbesserung der Osteointegration
Biocompatibel and bacteriostatic – Properties of Ca(OH)
2modified titanium surfaces to improve the osteointegration
Einleitung
Die Modifikationen von Implantatoberflächen im Knochenkontakt mit Calciumphosphaten ist eine bewährte Methode, um die Osteointegration zu verbessern [2]. Hydroxylapatit (HA, Ca10(PO4)6(OH)2), Hauptbestandteil des anorganischen Anteils von Knochen, ist das favorisierte Beschichtungsmaterial aufgrund seiner, das Anwachsen des Knochens fördernden Eigenschaften. Kommerziell kommen meist nur Plasma gespritzte Oberflächenmodifikationen zum Einsatz. Durch die hohen Prozesstemperaturen ist das Material kompakter und weist eine andere Kristallinität als knochenähnlicher Apatit auf. Mit dem Ziel diese Nachteile zu beseitigen, kommen vermehrt andere Beschichtungsmethoden wie Sputtern, Sol-Gel und elektrochemische Abscheidung zum Einsatz. Die hier vorgestellten, durch elektrochemische Abscheidung erzeugten Ca(OH)2 Modifikationen, biokompatibel und gleichzeitig bakteriostatisch, stellen eine interessante Alternative zu den derzeitigen Calciumphosphat- Beschichtungen dar.
Material und Methode
Korundgestrahlte Titan-Substrate bilden die Kathode in einem Elektrolyten, zusammengesetzt aus Ca(NO3)2, NH4H2PO4 und Zitronensäure. Als Anode dient eine Platinelektrode. Die Temperatur des Elektrolyten beträgt 50 °C. Ca(OH)2 wird bei Stromdichten > 100 mA/cm2 abgeschieden. Die Haftfestigkeit wurde mittels Ritztest, im Vergleich zu einer kommerziell erhältlichen, elektrochemisch abgeschiedenen Brushit (CaHPO4
*2H2O) Modifikation bestimmt.
Durch Einlegen in Zellkulturmedium (DMEM) [1] wird die Ca(OH)2 Modifikation der Oberfläche abgebaut und HA gebildet. Die Biokompatibilität wurde an Ca(OH)2
modifizierten Oberflächen sowie an den in DMEM umgewandelten Oberflächen bestimmt. Es wurden dazu Osteoblasten auf die Oberflächen ausgesät und die Proliferation und Zellaktivität (WST-Test) am 1-, 3-, 5- und 7-ten Tag bestimmt.
Die bakteroistatische Wirkung wurde für die beiden Bakterienstämme Staphylococcus epidermidis und Klebsiella pneumoniae getestet. Diese wurden in ihrer logarithmischen Wachstumsphase auf die Oberflächen gebracht, nach 24 Stunden fixiert, mit Fluoreszenz- farbstoff angefärbt und anschließend im Fluoreszenz- spektrometer vermessen.
Ergebnisse
Im Vergleich mit der kommerziell erhältlichen, Brushit modifizierten Oberfläche zeigt die Ca(OH)-
oberhalb 10 N. Die Brushit-Beschichtung hingegen zeigt keine Deformation aber partielle Ablösungen ab 4N.
Kräfte über 7 N bewirken ein Abplatzen über den gesamten Testbereich.
Als Referenz für den Osteoblasten-Zelltest diente Polystyrol und cp-Titan. Auf Polystyrol war die maximale Population am 5. Tag erreicht. Die Zellzahl auf den Ca(OH)2 modifizierten Proben lag bei zirka 30 % dieser maximalen Population am siebten Tag. Die Zellaktivität war an allen Tagen vergleichbar hoch.
Das Bakterienwachstum auf den Ca(OH)2 modifizierten Oberflächen ist um zirka 90 % für Klebsiella pneumoniae und um zirka 70 % für Staphylococcus epidermidis im Vergleich zu Al2O3-gestrahlten Oberflächen minimiert.
Diskussion
Die Haftfestigkeiten der vorgestellten Ca(OH)2
Modifikationen sind vergleichbar mit kommerziell erhältlichen Brushit-Beschichtungen. Die Schicht wird bei niedrigeren Kräften (2N) deformiert, löst sich aber erst bei Einwirkung deutlich höherer Kräfte (10N) ab.
Die bakteriostatische Wirkung (bis 90 %) kann mit einem gehemmten Zellwachstum in den ersten Tagen korreliert werden, wobei die Zellaktivität unbeeinflusst bleibt. Durch die Umwandlung der Modifikation von Ca(OH)2 zu HA in den ersten Tagen [1] im Zellkulturmedium verliert die Oberflächenmodifikation ihre bakteriostatische Wirkung bei beschleunigtem Zellwachstum. Die hier vorgestellten Ca(OH)2
Modifikationen sind somit im Infektionskritischen Moment des Eingriffs bakteriostatisch. Anschließend wird in den ersten darauf folgenden Tagen durch Biomineralisation von HA die Oberfläche auto- biokompatibilisiert, um eine Osteointegration zu ermöglichen.
Literatur
[1] Braun W., Thull R.: Hydroxylapatitbildung nach elektrochemischer Ca(OH)2 Oberflächenmodifikation von Titan. BIOmaterialien 5(3): 152, 2004 Tagungsband [2] Jaffe W., Scott D.: Total Hip Arthroplasty with Hydroxyapatite-Coated Prostheses.
J Bone Joint Surg Am.78:1918-34, 1996. Review Korrespondenzanschrift
Dr. rer. nat. W. Braun
Abteilung für Funktionswerkstoffe der Medizin und Zahnheilkunde, Universitätsklinikum Würzburg Pleicherwall 2
C. Burkhardt1, H. Wolburg2, A. Heeren3, W. Henschel3, D. P. Kern3, W. Nisch1
Elektronenmikroskopische Untersuchung der Grenzfläche zwischen Zellmonolayern und nanostrukturierten Titanoberflächen
Investigation of the Interface between Cell Monolayers and Nano Structured Titanium Surfaces by Electron Microscopy
Einleitung
Die Elektronenmikroskopie (EM) ist für die Analyse der Ultrastruktur biologischer Proben seit langer Zeit ein etabliertes Untersuchungsverfahren. Eine wichtige Präparationsmethode für die EM ist die Einbettung der biologischen Proben in einem Polymer und das Schneiden dieser Proben zu dünnen Schnitten in einem Ultramikrotom. Es ist jedoch nur mit sehr großem Aufwand möglich, mit dem Ultramikrotom die Grenzfläche zwischen hartem Material und weichem biologischem Gewebe zu präparieren [1]. Die elektronenmikroskopische Analyse dieser Grenzfläche erschließt dabei aber wichtige Informationen zum Zellwachstum auf mikro- bzw. nanostrukturierten Werkstoffen und funktionellen Oberflächen.
Material und Methode
Die Nanostrukturen wurden mit Hilfe von Elektronen- strahllithografie in HSQ (Hydrogensilsesquioxane) [2]
auf Siliziumsubstraten hergestellt und mit einer 10 nm dünnen Titanschicht besputtert. Nach Besiedeln dieser Substrate mit Zellen wurden diese in Glutaraldehyd fixiert und mit Osmium kontrastiert und schließlich in Araldit eingebettet [1]. Von diesen Proben wurden dann in einem Zeiss Crossbeam FIB/FESEM (Focused Ion Beam/Field Emission Scanning Electron Microscope) Querschnitte präpariert [3] und die mit Hilfe von FIB hergestellten Querschnitte im FESEM abgebildet.
Ergebnisse
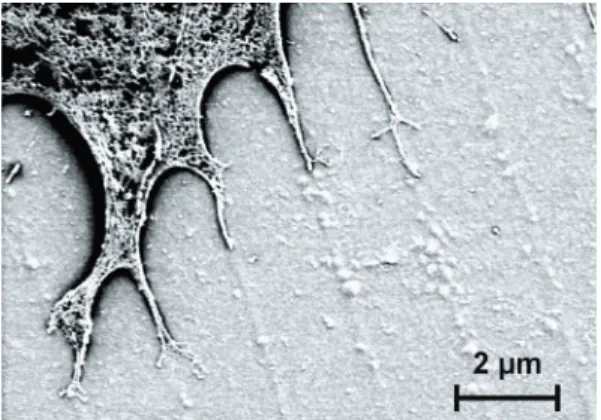
Abb. 1: Rasterelektronenmikroskopische Abbildung eines Querschnitts an der Grenzfläche zwischen Zelle und einer Nanostruktur mit 100 nm breiten Stegen
Abb. 2: Rasterelektronenmikroskopische Abbildung eines Querschnitts an der Grenzfläche zwischen Zelle und einer nanostrukturierten Titanschicht. In der rechten Bildhälfte ist die Zellschicht vom Substrat abgelöst.
Diskussion und Ausblick
Die Focused Ion Beam Methode kombiniert mit einem hochauflösenden Rasterelektronenmikroskop erschließt neue Möglichkeiten für die Untersuchung der Ultrastruktur von Zell-Substratkontakten. Um den direkten Vergleich mit der etablierten Transmissions- elektronenmikroskopie (TEM) an Ultradünnschnitten zu erlauben, können ergänzend an definierten Stellen der Probe TEM Lamellen mit Hilfe einer in-situ lift-out Technik entnommen werden.
Literatur
[1] Pfeiffer F., Herzog B., Kern D. P., Scheideler L., Geis-Gerstorfer J., Wolburg H.: Microelectronic Eng.
67-68:913-922, 2003
[2] Henschel W., Georgiev Y. M., Kurz H.: J. Vac. Sci.
& Technol. B 21-5:2018-2025, 2003
[3] Burkhardt C., Nisch W.: Pract. Metallogr. 42:161- 171, 2005
Korrespondenzanschrift
1 Dr. Claus Burkhardt
NMI Naturwissenschaftliches und Medizinisches Institut Markwiesenstrasse 55
D-72770 Reutlingen
2 Institut für Pathologie, Universität Tübingen
3 Institut für Angewandte Physik, Universität Tübingen
M. Chatzinikolaidou, H.P. Jennissen
Immobilisierung von BMP-2 auf Titanplasmaspray-beschichteten Titanimplantaten mit biologisch aktiver Wirkung
BMP-2 Immobilization on Titanium Plasma Sprayed Implants with bioactive Effect
Introduction
Recently we have shown that bone morphogenetic protein 2 (BMP-2) can be immobilized on model surfaces such as electrolytically polished titanium leading to bone growth and osseointegration. In expanding this work, we now investigate real implant surfaces which are in medical use, such as titanium plasma spray coated (TPS) implants having very high surface areas. Adsorption and release of immobilized rhBMP-2 in the native state were investigated inin-vitro and in-vivo experiments.
Materials and Methods
Two methods of chemical immobilization of rhBMP-2 were developed: covalently and non-covalently bound self prepared rhBMP-2 [1]. For non-covalent immobilization on chromosulfuric acid treated (CSA) titanium plasma sprayed surfaces native rhBMP-2 was hydrophobically adsorbed to an alkylsilane substituted (3-aminopropyltriethoxysilane, APS) titanium surface of high alkyl surface concentration. Covalent immobilization to these surface was enabled via silanization with APS and then coupling propylamino group withİ-amino group of lysine residue of protein by 1,1´-carbonyldiimidazole (CDI). By means of confocal laser scanning electron microscopy a ratio of real area/geometric area of 20 could be calculated.
Radioactively labelled 125I-rhBMP-2 was prepared according to Chloramin-T method.
The biological activity of immobilized rhBMP-2 was measured in the mouse osteoblast cell line MC3T3-E1 by in-situ activation of alkaline phosphatase and illustrated by fluorescence microscopy [2]. The biological activity of rhBMP-2 coated implants in-vivo was curried out in a gap healing model in a sheep condylus after 4 and 9 weeks [3].
Results
Immobilization of125I-rhBMP-2 leads to amounts of 5.2 µg/cm2for non-covalently and 9 µg/cm2 for covalently bound protein respectively.
Table 1: Immobilization of 125I-rhBMP-2 (cBMP-2=0.25 mg/ml) on ideal titanium and implantable titanium plasma coated miniplates
Implant surface Modification Immobilized BMP-2 [ng/cm2]
CSA Per geometric
area Per real area Titanium
electropolished APS
APS-CDI 238 ± 57
886 ± 371 96 Titanium APS 5221 ± 293 360 260
The evaluation of the desorption kinetics indicates a biphasic release with a short initial fast phase followed by a slower second long term release.
0 2 4 6 8 10 12
0 2000 4000 6000 8000 10000
APS CDI Desorption of125I-BMP-2 in PBS pH 7.4 from Titanium plasma sprayed surfaces
t0.5=0.02 / 34 d
t0.5=0.02 / 25 d
Time [d]
Immobilized amount[ng/cm2]
Fig. 1: Desorption of125I-rhBMP-2 from titanium plasma spray coated implants
Fig. 2: Induction of alkaline phosphatase as proof of biological activity of immobilized rhBMP-2 on titanium plasma spray coated titanium miniplates in the osteoblast cell line MC3T3-E1. The fluorescence microscopic image shows a direct comparison between controls (black) and BMP-2 coated (bright) titanium surfaces Discussion
Immobilization studies demonstrated that BMP-2 can be covalently and non-covalently bound on modified titanium plasma spray coated surfaces in amounts up to 9 µg/cm2. In a desorption experiment we showed that bound BMP-2 released with half lives of 25 – 35 d making such surfaces applicable as long term drug delivery devices for enhancing bone growth and osseointegration of implant materials. In future work we plan to achieve a dose-response curve in-vivo.
References
[1] Chatzinikolaidou M., Laub M., Rumpf H., Jennissen H. P.:
Biocoating of Elektropolished and Ultra-Hydrophilic Titanium and Cobalt Chromium Molybdenum Alloy Surfaces with Proteins. Materialwiss. Werkstofftech. 33: 720-727, 2002 [2] Chatzinikolaidou M., Zumbrink T., Jennissen H. P.:
Stability of surface-enhanced ultrahydrophilic metals as a basis for bioactive rhBMP-2 surfaces. Materialwiss. Werkstofftech.
34: 1106-1112, 2003
[3] Jennnissen H. P.: Accelerated and improved osteointe- gration of implants biocoated with bone morphogenetic protein 2 (BMP-2). Annals N. Y. Acad. Sci. 961: 139-142, 2002 Corresponding address
Institut für Physiol. Chemie, Universitätsklinikum Essen
S. Chauhan, R.M. Shelton, M.P. Hofmann
Verhalten von Calciumphosphat-Knochenzement im Pasten/Blut-Mischbereich Behaviour of calcium phosphate bone cement in the paste/blood intermixing area
Introduction
Calcium phosphate bone cements are intended to form rigid structures after setting in vivo. During insertion of the cement pastes into bony defects there inevitably will be contact with blood that contains 6.5 to 8 wt%
proteins. Thus a cement paste/blood serum mixture forms an interfacial layer between the bone and set cement. The aim of this study was to investigate the effect of admixed serum proteins on the mechanical strength, setting time and microstructure of the interfacial layer of a brushite bone cement system.
Materials and Methods
The cement system was an equimolar -tricalcium phosphate (- T C P ) / m o n o c a l c i u m p h o s p h a t e monohydrate (MCPM) powder mixture setting to brushite in an aqueous environment. The powder mixtures were hand mixed for 30s at a powder to liquid (P/L) ratio of 2.8 and 2.2g/ml, the latter simulating a diluted paste at the blood/cement interface layer, with the liquid phase consisting of 800mM or 500mM citric acid retardant solution respectively. To evaluate the effect of different proteins and protein concentrations, the reactant powder mixtures were also mixed with the liquid phase additionally containing 0.1, 0.5, 1 and 10wt% of albumin, fibrinogen or foetal bovine serum.
These slurries were cast into a cylindrical PTFE mould (6 x 12mm) and left to set for 1h in a humid environment at 37 °C. After another 24 h immersion in water at 37 °C the wet compressive strengths of the cements were measured with a universal testing machine. Strut densities of the set cements were measured using helium pycnometry. The relative porosities of the set cement samples were calculated from apparent wet, dry and strut densities. Initial and final setting times of the cement slurries were determined by a standard Gilmore needles test. Scanning electron microscopy (SEM) was used to evaluate the effect of protein admixing on the microstructure of the set cement.
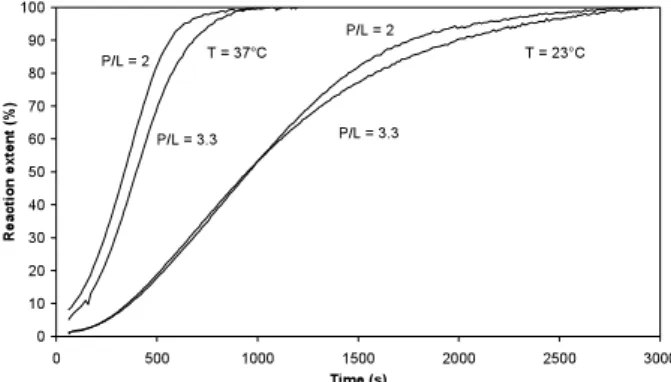
Results
Increasing protein content up to 10wt% led to a significant deterioration in strength for admixture concentrations of more than 0.1wt% and was accompanied by an increase in relative porosity, (see table 1). Pycnometry measurements showed that the equimolar reactants -TCP ( = 3.10g/cm3) and MCPM (2.37g/cm3) set almost completely to brushite (2.3g/cm3) for all admixtures, as measured densities were in the region of 2.32 to 2.40g/cm3.
Initial setting times for the P/L 2.5g/ml system increased slightly from 14 to 15-16min for albumin and bovine serum admixtures but changed significantly to 21min for fibrinogen addition.
Brushite crystal shape was observed to change with the type of admixture using SEM. Smaller crystals formed in the presence of albumin, whilst fibrinogen decreased the interwoven nature of crystals and clusters formed in the presence of bovine serum.
Table 1: Wet compressive strength and relative porosity of set cement with different admixtures.
Compressive strength [MPa]
Relative porosity [%]
P/L ratio [g/ml] 2.2 2.8 2.2 2.8
No protein 12.0 ± 1.6 16.6 ± 3.4 40 33
0.1 wt% albumin 10.8 ± 1.2 14.9 ± 2.6 40 36 0.5 wt% albumin 8.1 ± 2.2 10.2 ± 3.1 41 36 1.0 wt% albumin 6.7 ± 1.3 8.8 ± 2.1 43 39 10 wt% albumin 8.0 ± 3.6 8.0 ± 1.4 43 41 0.1 wt% fibrinogen 10.6 ± 1.6 12.9 ± 1.5 40 33 1.0 wt% fibrinogen 8.2 ± 1.7 7.9 ± 1.7 39 36 0.5 wt%/0.5 wt%
albumin/fibrin. 5.5 ± 0.8 7.0 ± 1.1 43 38 1.0 wt%
bovine serum 8.2 ± 1.2 9.1 ± 1.9 40 36
Discussion
The dramatic decrease in mechanical strength of a calcium phosphate cement when mixed with proteins or serum may be explained by a combination of several mechanisms: Firstly an increase in porosity by dilution of the paste and poorer mixing caused by the admixture are known to lead to lower mechanical strength [1].
Secondly admixed proteins are likely to cause flaws when incorporated in a set cement and thirdly the proteins introduced inhomogeneities to the microstructure of precipitated brushite crystals.
Conclusion
The study clearly indicated that the inevitable admixing of proteins or serum even at low concentrations during application of bone cements was a crucial factor in determining the final mechanical strength of such materials and needs to be considered during future developments.
References
[1] T. Takahashi et al Adv. Cem. Res. 1997, 9, 25 Acknowledgements
We acknowledge the support of the EU by the FP 6 Mob. 5 Marie Curie Fellowship 500694 (M.P.Hofmann).
Correspondence Dr. Richard M. Shelton
Biomaterials Unit, School of Dentistry, University of Birmingham
St Chad`s Queensway
United Kingdom-B4 6NN Birmingham
B. Denkena, C. Podolsky, A. Lucas, T. Hassel, F. Witte, O. Palm, C. Hurschler
Herstellung resorbierbarer medizinischer Implantate aus Magnesium Processing of degradable surgical implants made of magnesium alloys
Introduction
Magnesium alloys seem to be suitable as degradable biomaterials. The magnesium degradation in vivo is based on a corrosion process that is basically controlled by the alloying elements [3]. It is further known, that the mechanical processing of magnesium alloys as well as the shape of the magnesium surface can influence the corrosion rate as well as the mechanical properties [1, 2].
Materials and Methods
In an interdisciplinary project, the influence of the manufacturing process of cortical screws made of different magnesium alloys on the mechanical and corrosive properties of these implants is investigated. A main purpose of this study is to analyse how different designs of magnesium screws can match the mechanical requirements for small screw implants. Magnesium screws of different geometries are compared to commercially available standardized cortical screws made of stainless steel.
serial A one medium sized lathe tool consequence:
edge size varying
serial B:
lathe tools small, medium and broad consequence:
edge size constant P = 1,00 mm P = 1,25 mm P = 1,50 mm pitch
1mm
:
Fig. 1: Geometry Variations Results
No significant difference in pull out and compression tests were detected for the stainless steel screws compared to magnesium screws with similar geometry.
0 200 400 600 800 N 1200
AZ91 serial B
P=1,0 mm AZ91 serial B
P=1,25 mm AZ91 serial B
P=1,5 mm Steel ISO 5835 P=1,25 mm
pull-out forces compression forces
Fig. 2: Biomechanical Results
In laboratory corrosion tests, AZ91-screws showed a strong local corrosion, a more homogenous corrosion attack was observed on magnesium-calcium-alloys.
However, the corrosion resistance of the investigated magnesium alloys still needs to be increased markedly.
Discussion
The application of magnesium implants is feasible.
Further research will focus on obtaining an optimal combination of mechanical and corrosive properties of the implant by selecting the most suitable magnesium alloy as well as on the definition of the optimal corresponding parameters for the mechanical processing.
References
[1] Denkena B., Tönshoff H. K., Friemuth T., Frank M., Gey C., Podolsky C.: Safe Machining of Magnesium with CVD-DP and Smooth CVD-DP Coated Tools. In:
SME (Society of Manufacturing Engineers),Technical Paper FC02-264, 2001
[2] Tönshoff H. K., Haferkamp H., Friemuth T., Niemeyer M., Kaese V., Janssen S., Winkler J., Podolsky C.: Einfluss des Festwalzens auf die Oberflächen- und Randzoneneigenschaften der Magnesiumlegierung AZ31 und AZ91. Sonderband Magnesiumtechnologie. In: Materialwissenschaft und Werkstofftechnik, 2001
[3] Witte F., Kaese V., Haferkamp H., Switzer E., Meyer-Lindenberg A.: Wirth, C.-J.; Windhagen, H.: In vivo corrosion of four magnesium alloys and the associated bone response. Biomaterials, in press
Correspondences
Prof. Dr.-Ing. Berend Denkena, Dipl.-Ing. Christian Podolsky, Dipl.-Ing. Arne Lucas
Inst. f. Fertigungstechnik u. Werkzeugmaschinen (IFW) Dipl.-Ing. Thomas Hassel
Inst. f. Werkstoffkunde (IW)
Produktionstechnisches Zentrum, Universität Hannover Schönebecker Allee 2, 30823 Garbsen
Tel.: +49 (0)511 762-2553, Fax: +49 (0)511 762-5115 Dr. med. Frank Witte, Dr.-Ing Christof Hurschler, Oliver Palm,
Labor für Biomechanik und Biomaterialien (LBB), Orthopädie der Medizinischen Hochschule Hannover Anna-von-Borries Str. 1-7, 30625 Hannover
Tel.: +49 (0)511 5354-546, Fax: +49 (0)511 5354-875 Acknowledgements
The authors acknowledge the financial support of project R4 ”processing of implants” of the Colloborative Research Center 599 founded by the German Research Foundation (DFG).
Rainer Detsch, Bettina Hoffmann, Helmar Mayr und Günter Ziegler
Induzierte Resorption von Hydroxylapatitkeramik durch Biofunktionalisierung Induced Resorption of Hydroxyapatite Ceramic through Biofunctionalisation
Einleitung
Ein Knochendefekt, verursacht z.B. durch einen Tumor oder ein Trauma, kann mittels Knochenersatzmaterialien regeneriert werden. Dabei kommen neben autologen und allogenen auch synthetische Calciumphosphate wie Hydroxylapatit (HA) zum Einsatz [1]. Obwohl HA- Keramiken eine hohe Biokompatibilität aufweisen, können sie Jahre nach der Implantation an Hand von Röntgenaufnahmen noch nachgewiesen werden. Die einzigen Zellen, die in der Lage sind Knochen und eventuell auch Knochenersatzmaterialien zu resorbieren, sind Osteoklasten. Diese Zellen entstehen aus hämopoetischen Stammzellen, besitzen mehrere Zellkerne und formen den so genannten Aktinring [2].
Als Modell wurde in dieser Studie eine humane Monozyten Zell-Linie auf einer biofunktionalisierten Hydroxylapatitkeramik kultiviert. Dabei sollte gezeigt werden, ob durch kovalent gekoppelte Wirkstoffe eine Osteoklastenaktivierung und eine Resorption der HA- Oberfläche induziert werden kann.
Material und Methode
Die verwendeten Hydroxylapatitproben (Durchmesser 15 mm) wurden aus einem kommerziellen Pulver mittels Pressen hergestellt. Nach Sinterung bei 1300°C entstand eine phasenreine, dichte Keramik. Anschließend erfolgte die kovalente Kopplung von 1,,25-Hydroxyvitamin D3
(VD3) und 12,13-Phorboldibutyrat (PDBu). Diese Substanzen, die die Zelladhäsion, Zellfusion und den Calciumstoffwechsel regulieren, wurden sowohl einzeln als auch in Kombination auf die Oberfläche gebunden.
Dazu wurde in einem ersten Schritt die Oberfläche mit 3-Aminopropyltriethoxysilan aktiviert. Als Spacer wurde ein 4-Azido-1-fluor-2-nitrobenzol verwendet. In einem letzten Schritt wurden die Hormone durch UV-Strahlung gebunden. Neben den Hydroxylapatitproben wurden auch Glasplättchen mit TiO2-Beschichtungen für Vorversuche zur mikroskopischen Untersuchung funktionalisiert.
Die Kultivierung der humanen Monozyten U-937 auf den Probekörpern fand in RPMI mit 10 % fötalem Kälberserum und 1 % Antibiotika statt. Als Proben wurden Bulkmaterialien (HA und Glas + TiO2), die beiden einzelnen Substanzen und auch die Mischung gekoppelt untersucht. Nach 7 Tagen wurde das verbrauchte Kulturmedium abgezogen und die adhärent gewachsenen Zellen analysiert. Die Zellvitalität wurde mittels Mitochondrienaktivität (WST-1) untersucht. Die Bildung von multinucleären Zellen und eines Aktinrings wurden durch Immunfluoreszenz ermittelt. Ein typischer Osteoklastenmarker (Tartrate Resistent Acid Phosphate) wurde lichtmikroskopisch analysiert. Neben der Zellmorphologie wurde auch die Lakunenbildung mittels Rasterelektronenmikroskop (REM) analysiert.
Ergebnisse
Die Analysen der Vorversuche mit TiO2-Schichten zeigten, dass sich bei den Bulkmaterialien und bei den VD3 modifizierten Oberflächen keine mehrkernigen Zellen gebildet haben. Ausschließlich bei PDBu und der Kombination bildeten sich mehrkernige Riesenzellen.
Bei den Untersuchungen der modifizierten HA-Proben zeigte sich sowohl bei den einzelnen Substanzen als auch bei der Kombination der gekoppelten Substanzen keine einheitliche Zellmorphologie. Obwohl mehrkernige Zellen auch auf PDBu und VD3 funktionalisierten Oberflächen detektiert werden konnten, wurden nach dem Ablösen der Zellen von den HA-Oberflächen ausschließlich auf HA Oberflächen mit beiden in Kombination gekoppelten Wirkstoffen Resorptions- flächen gefunden (Abb. 1).
Abb. 1: REM-Aufnahmen
a) einer U-937 Osteoklasten ähnlichen Zelle, kultiviert über 7 Tage auf einer funktionalisierten HA-Oberfläche (links). b) HA-Oberfläche nach dem Ablösen der Zellen;
Lakunenbildung (rechts).
Diskussion
Die hier ermittelten Ergebnisse zeigen, dass durch die verwendeten Wirkstoffe in Kombination eine Differenzierung der Monozyten Zell-Linie zu Osteoklasten ähnlichen Zellen erreicht wurde. Eine Resorption von HA-Keramiken in vitro konnte durch Biofunktionalisierung induziert werden. In weiteren Versuchen muss geklärt werden, wie mit geeigneten Wachstumsfaktoren primäre Monozyten bzw.
hämopoetische Stammzellen zur Osteoklastogenese auf HA und anderen Calciumphosphat-Kermiken differenziert werden können.
Literatur
[1] Willman, G.: Medical grade hydroxyapatite: state of art. British Ceramic Transactions 95, 212–216, 1996 [2] Väänänen H. K, et al: How do osteoclasts resorb bone? Mat. Science and Eng. C 6 205–209, 1998 Korrespondenzanschrift
Rainer Detsch
BioCer Entwicklungs - GmbH Ludwig-Thoma-Str. 36c Deutschland, 95447 Bayreuth
Hermann Ehrlich1, Thomas Hanke1, Paul Simon2, Caren Göbel2, Sascha Heinemann1, René Born1, Hartmut Worch1
Demineralisation von natürlichen Silikat-basierten Biomaterialien: eine neue Strategie zur Isolation organischer Gerüststrukturen
Demineralization of natural silica based biomaterials: a new strategy for the isolation of organic frameworks
Introduction
Marine glass sponges (Hexactinellida: Porifera) provide an abundant source of very unusual skeleton structures and inspire investigations aiming to gain a better understanding of biosilification mechanisms, which can be used to develop new biomimetic based biomaterials.
Different representatives of Hexactinellida are remarkable for their anchoring spicules, which are glassy fibres several millimetres in diameter and up to one meter in length. They exhibit remarkable flexibility, thus giving the impression for being an almost unbreakable glass, which can be easily bent into a full circle. The origin and the possible role of the organic matrix within these silica-containing skeletal formations are still unknown. With the aim of demineralising skeletal structures in marine glass sponges, in the present work a strategy consisting of the slow etching of a silica- containing component based on the use of different alkaline solution was applied for the first time.
Materials and Methods
The object of our study was Hyalonema sieboldi Gray 1835 collected in the Pacific Ocean, water depth 5000 meters. Our strategy for sponge spicules demineralization was based on the newly developed slow etching methods, using solutions of either of 2.5 M NaOH (pH 12.0), or at least of 1% sodium dodecylsulfate (SDS) (pH 8.0), or of 1% rhamnolipid biosurfactant (pH 8.0) at 37°C. To test our hypothesis that an organic matrix within the H. sieboldi spicules is responsible for the extraordinary mechanical properties, structural (SEM, TEM, AFM, LSM, XRD, FTIR, Ra ma n) an d b ioc he mi cal (HPLC, PAAG- Electrophoresis, MALDI) analyses of these glassy composites and extracted proteinaceous components were performed.
Results
The results of the physico-chemical analysis suggested that the H. sieboldi spicules are composed of amorphous silica in the form of opal A. As a result of the application of the slow etching strategy, data unequivocally confirming the presence of a fibrillar protein organic matrix was obtained (Fig. 1). This matrix acts as a template for the biomineralization of silica in basal spicules of H. sieboldi. We also established for the first time that this protein matrix consists of a protein of a collagenous nature. It is concluded that the H. sieboldi spicule is an example of a “silificated protein matrix”
rather than of a “protein-containing silica matrix”.
Fig. 1: SEM image of H. sieboldi spicules treated with alkali solution present strong evidence that the multifibrillar organic matrix is the template for silica mineralization
Conclusion
Recent interest in the biomaterial properties of silica- containing structures made by living sponges has been evoked. In order to exploit the mechanisms for the synthesis of advanced materials and devices, investigations of the nanoscale structure of the three dimensional networks of these remarkable biomaterials have to be performed. Truly understanding the Hyalonema’s collagen templating activity for silica mineralization could be the key to developing new biomimetically fabricated protein-based silica materials for biomedical and technical applications. The methodical approach which we suggest could be of great importance for the study of the structural organisation of skeletons of other kinds of silica-containing natural materials and organisms.
Correspondence Hermann Ehrlich
1Max Bergmann Center of Biomaterials Institute of Materials Science
Budapester Str. 27
D-01069 Dresden, Germany
email: Hermann.Ehrlich@mailbox.tu-dresden.de
2Max Plank Institute of Chemical Physics of Solids Nöthnitzer Str. 40
D-01187 Dresden, Germany
F.A. Müller, L. Müller, C. Zollfrank, P. Greil
Photoluminescence of biomimetically derived apatites Photolumineszenz biomimetisch erhaltener Apatite
Introduction
Bioactive fixation of a bone implant involves the formation of a biologically active hydroxy carbonated apatite (HCA) layer on the implant surface. It was shown, that the formation of a bonelike HCA surface layer and the resultant bone-bonding ability of an implant can be evaluated by testing the material in an acellular simulated body fluid (SBF) with ion concentrations nearly equal to those of the inorganic part of human blood plasma.
Photo-stimulated luminescence (PL) of biocompatible materials is an appealing approach to observe the distribution of bioactive compounds in surgery, tissue engineering or bone re-modelling. In this paper, we report on the manufacturing and properties of inherent luminescent bioactive apatite coatings on titanium implant surface.
Materials and Methods
Commercially pure titanium plates were etched in hydrochloric acid and subsequently treated with aqueous 10 M NaOH solution. The chemically activated titanium samples were exposed to SBF for two weeks to obtain homogeneous, dense HCA coatings (biomimetic apatite) with an average thickness of 10 µm. The HCA coated samples were hold at temperatures between 200 and 800 °C in air for 1 hour and characterised by FT-IR, XRD, TEM, ESEM and ICP-OES. The photo- luminescence spectra were recorded with a fluorescence spectrometer (J&M Analytische Mess- und Regeltechnik, Germany) equipped with fibre optics for excitation and detection of the emission.
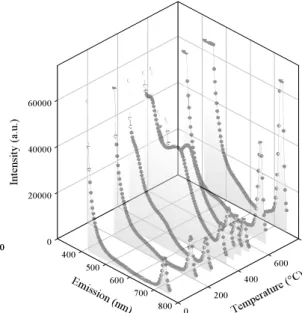
Results and Discussion
The XRD patterns of chemically activated titanium exposed to SBF with biomimetic apatite coating were identified as HCA of low crystallinity. A preferred crystallographic orientation in respect to the c-axis of the hexagonal apatite crystals was implied due to the higher relative peak intensity of the (0002) and (0004) planes compared to the 100 % intensity peak of the (2131) plane. The crystallite sizes calculated from the peak broadening (Scherrer) increased from 7.5 nm after precipitation at room temperature to 8.3, 9.0 and 13.1 nm after annealing to 200, 400 and 600 °C, respectively.
The development of a blue (437 nm) and a chartreuse (green-yellow, 556 nm) photoluminescence (PL) emission was observed for biomimetic apatites annealed at different temperatures between 200 and 800 °C (fig. 1.) The PL-intensity increased with rising temperature up to a maximum peak intensity at 350 °C for the blue and at 375 °C for the chartreuse emission. A considerable amount of chlorine (2.8 atom- %) was
detected by TEM-EDS in the calcium phosphate particles annealed at 200 - 600 °C which exhibited pronounced luminescence (as known from halophosphate phosphors in illumination industry). Cl- is supposed to substitute for OH- forming chloroapatites.
Since the Ti plates were activated with 37 wt.- % HCl, Cl- is likely to be incorporated in a surface near region.
During annealing at elevated temperatures the Cl- might diffuse into the apatite layer, giving rise for the Cl- content detected by TEM-EDS. The blue and the chartreuse emission, however, vanished at temperatures exceeding 600 °C. Temperature induced sublimation of alkali chlorides lead to a depletion of halogen content in the biomimetic apatite coating. After annealing to 800 °C the Cl- concentration was reduced to 0.1 atom-%.
The PL of the biomimetic apatite coatings might be of interest for histological probing and monitoring bone re- modelling process.
0 20000 40000 60000
400 500
600 700
800 0 200
400 600
Intensity (a.u.)
Emission (nm) Temperature(°C) 00
b)
0 20000 40000 60000
400 500
600 700
800 0 200
400 600
Intensity (a.u.)
Emission (nm) Temperature(°C) 00
b)
Fig. 1: Emission spectra of biomimetic apatite coatings at the excitation wavelength of 371 nm as function of annealing temperature.
Correspondence Frank A. Müller
University of Erlangen-Nuernberg
Department of Materials Science III - Biomaterials Henkestr. 91
91052 Erlangen