Escherichia coli -Stress auf Physiologie und Threoninproduktion von Untersuchungen zum Einfluss von pH- und CO
Volltext
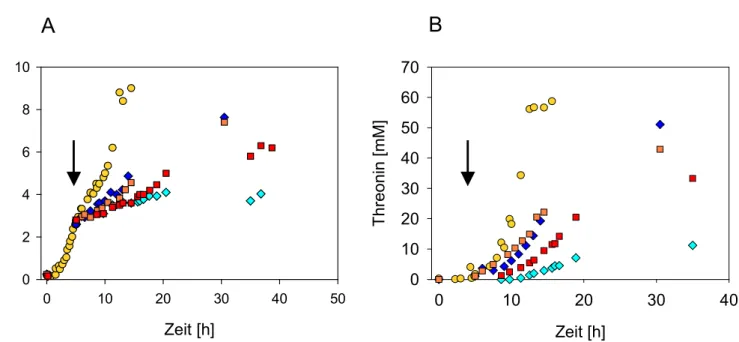
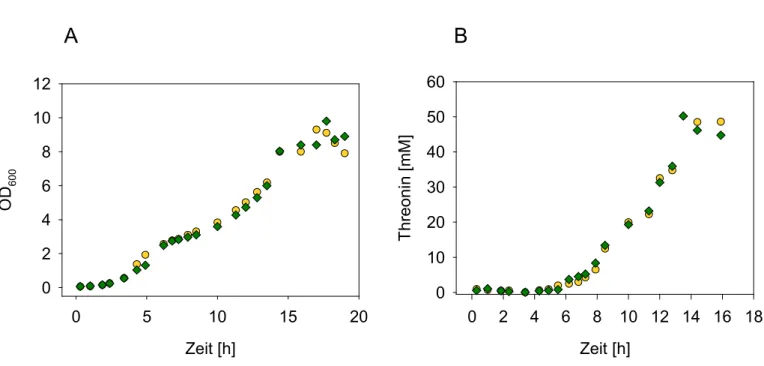
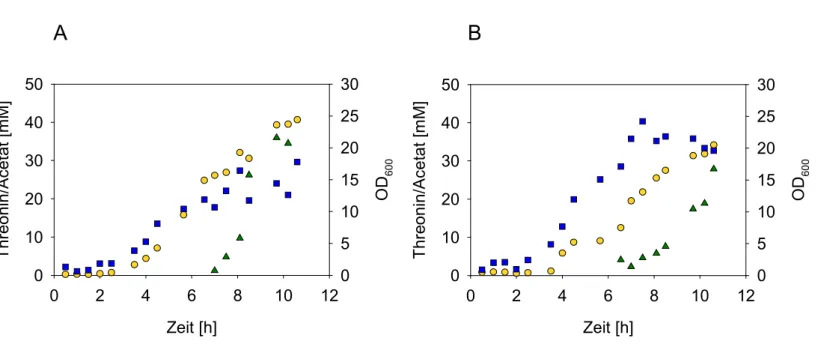
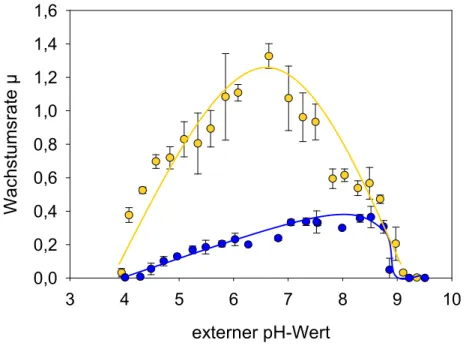
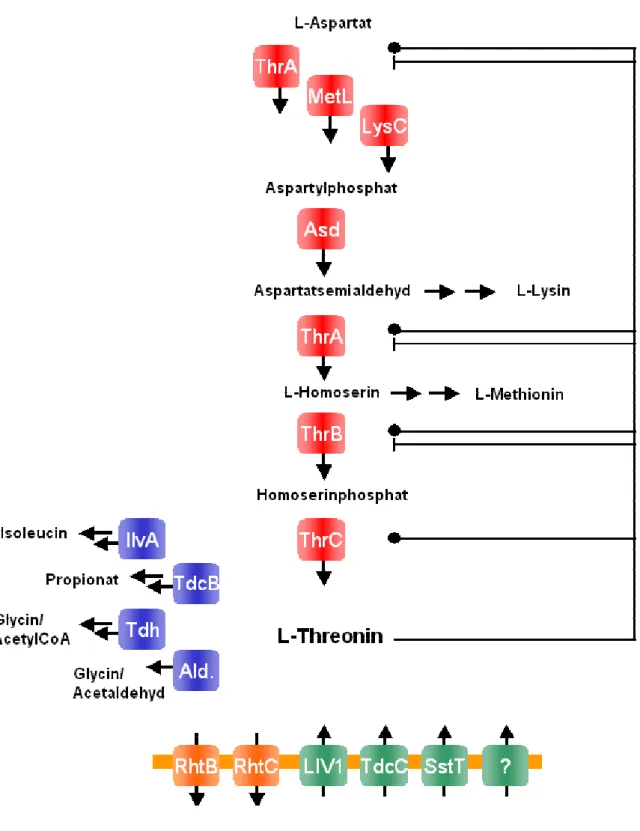
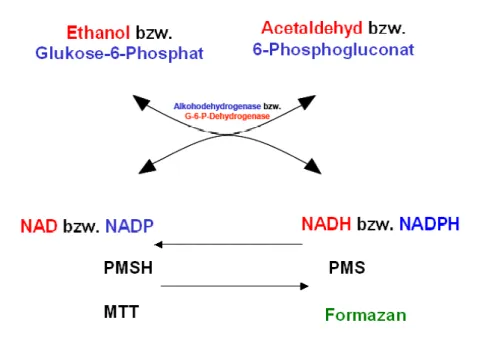
Abbildung


ÄHNLICHE DOKUMENTE
A large outbreak of hemolytic uremic syndrome caused by an unusual sorbitol-fermenting strain of Escherichia coli O157:H- J.. Hemolytic uremic syndrome: epidemiology,
Da die Fluorchinolone vollsynthetisch hergestellt werden und ein niedriges endogenes Resistenzpotential aufweisen (Mutationen in mehreren Zielstrukturen der
Die Ähnlichkeit zwischen bovinen und humanen EHEC´s sowie die zunehmende Isolierung von Stämmen der Serogruppe O118 auch vom Menschen (17, 83, 84, 105) gab Anlaß zu der
Presence and Characterization of Extraintestinal Pathogenic Escherichia coli Virulence Genes in F165-Positive E.coli Strains Isolated from Diseased Calves and
STEC hingegen ohne Virulenzplasmide und/oder eaeA–Gen, die oft bei landwirtschaftlichen Nutztieren, insbesondere Rindern, zirkulieren und dementsprechend häufig
coli Tropfen sollten nicht während einer Antibiotika-Behandlung oder innerhalb von 5 Tagen nach ihrem Abschluss eingenommen werden (siehe auch Abschnitt 4.5).. Wenn die
Durch den Einsatz eines geeigneten Expressionssystems ist die Produktion und Aufreinigung größerer Mengen an Sialidase möglich, die für die Charakterisierung des Enzyms
Es kann jedoch nicht ausgeschlossen werden, dass für eine spezifische Bindung von RybA an TyrR andere Faktoren benötigt werden, die in vivo unter Peroxid-Stress