POSTOPERATIVES VORHOFFLIMMERN BEI PATIENTEN MIT UND OHNE SCHLAFAPNOE NACH AORTOKORONARER
Volltext
Abbildung
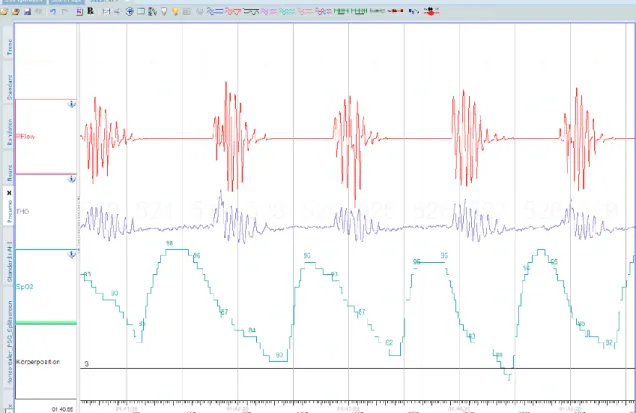

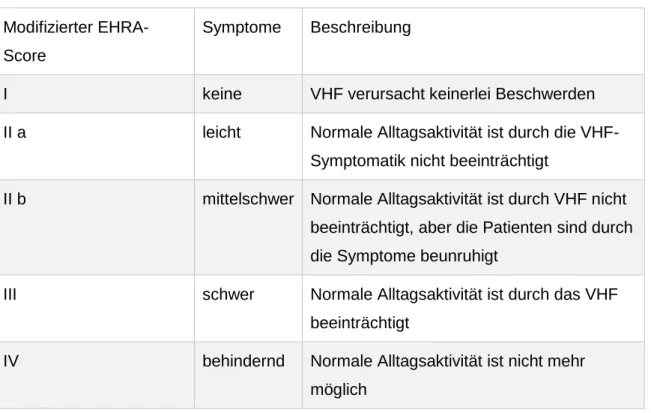
ÄHNLICHE DOKUMENTE
In der Kontrollgruppe wurde in der multivariablen Analyse nach sechs Monaten ein erhöh- ter NIHSS-Score (>3) als unabhängiger Prädiktor für Vorhofflimmern identifiziert
❖ Ein systematischer Review kommt zum Schluss, dass individuell angepasste Unter- kiefer-Protrusions-Zahnschienen in der The- rapie von Patienten mit leichter bis mittel-
❖ In der ARISTOTLE-Studie bei Patienten mit Vorhofflimmern und mindestens einem zu- sätzlichen Risikofaktor für Stroke reduzierte Apixaban im Vergleich zu Warfarin bei akzep-
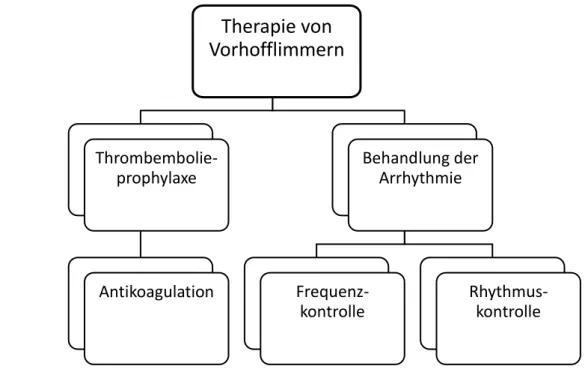
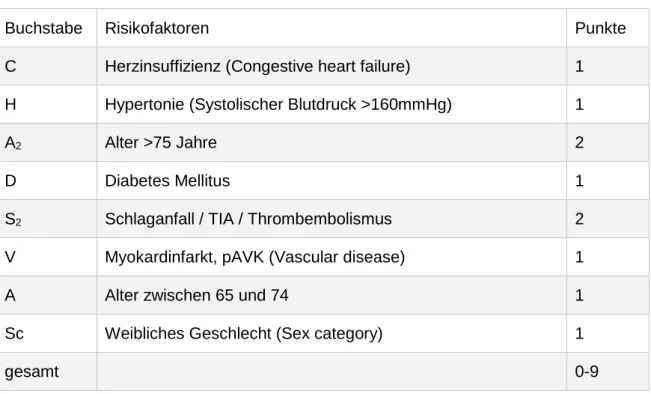
Risikostratifizierung bei chronischem Vorhofflimmern Im aktuell angewandten sogenannten CHADS 2 -Score (Cardiac Failure, Hypertension, Age, Diabetes, Stroke [ 2]) addieren sich in
In mehreren Studien konnte gezeigt werden, dass bei Verdacht auf eine KHK oder auch dem Vorliegen einer manifesten KHK mittels MDCT eine gute Beurteilung der
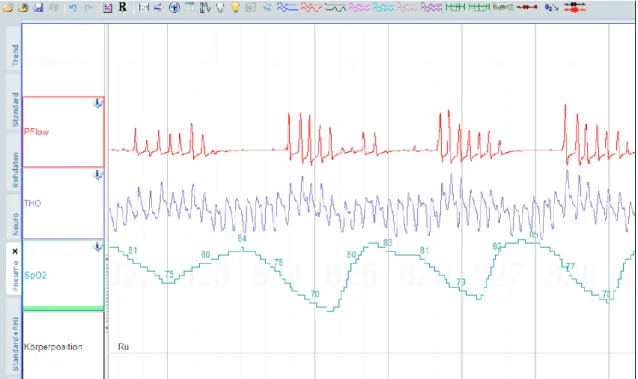
Die Vierfeldertafel in Tabelle 13 zeigt die Ergebnisse für den M-DES-OSA Score, wenn bei 5, 6 und 7 Punkten jeweils der Test als positiv gewertet wird für die Prädiktion
In unserer Studie zeigte sich bei der Unterteilung der Probanden in adipös und nicht- adipös, dass das Risiko eine OSA zu entwickeln zwar bei der Gruppe der Adipositas- Patienten
In der vorliegenden Studie konnte gezeigt werden, dass die Diskriminierungskriterien auf zuverlässige Weise angepasst werden können ohne falsch-negative Resultate zu erzielen – in