Als besonderen Service für die Leserinnen und Leser von BIOmaterialien drucken der
Verlag Neuer Merkur GmbH in Kooperation mit der Klinik für Orthopädie und Sportorthopädie (Direktor: Prof. Dr. med. R. Gradinger) die Abstracts (einschließlich Autorenliste)
zu folgender Veranstaltung ab:
10. INTERNATIONALE BIOMECHANIK- UND
BIOMATERIAL-TAGE MÜNCHEN
6. – 7. JULI 2007
Implantate für
Orthopädie und Traumatologie &
Tissue Engineerte Biomaterialien
im Hörsaal R 1.049 der Fachhochschule München Lothstraße 64, 80335 München
Veranstalter: Klinik für Orthopädie und Sportorthopädie der Technischen Universität München &
Fakultät Feinwerk- u. Mikrotechnik, Physikalische Technik, Fachhochschule München
Wissenschaftliche Leitung:
Prof. Dr. med. Reiner Gradinger
Prof. Dr.-Ing. Erwin Steinhauser
Bassil Akra M.Sc.
Herzchirurgische Klinik Marchioninistr. 15 D-81377 München Dr. med. Ulrich Böhling
Heliosklinikum Emil von Behring – Stiftung Oskar Helene Heim Waltershöferstr. 11
D-14165 Berlin
Dipl.-Ing. Gottfried H. Buchhorn Orthopädische Klinik,
Universität Göttingen Postfach 3742 D-37070 Göttingen
PD Dr. med. Rainer Burgkart Klinik für Orthopädie und Sportorthopädie, TU München
Ismaninger Str. 22 D-81675 München Dr. med. Peter Diehl Klinik für Orthopädie und Sportorthopädie, TU München
Ismaninger Str. 22 D-81675 München Dipl.-Ing. Sebastian Eberle BG Unfallklinik Murnau Biomechanik Forschungslabor Professor-Küntscher-Str. 8 D-82418 Murnau
Dipl.-Ing. (FH) Markus Geisendorf Züricher Hochschule Winterthur Institut für mechanische Systeme Technikumstr. 9
CH-8401 Winterthur Dipl.-Ing. (FH) Urs Gersbach Zimmer GmbH
Sulzer-Allee 8, P.O.Box
CH-8404 Winterthur Maximilian Haenle
Orthopädische Klinik und Poliklinik, Universität Rostock
Doberaner Str. 142 D-18057 Rostock
cand. med. Tobias Harnoß Klinik für Orthopädie und Unfallchirurgie TU München Abt. Biomechanik Connollystr. 32 D-80809 München
Dipl.-Ing. Konrad Hoffmeier Klinik für Unfall-,
Hand- und Wiederherstellungschirurgie Klinikum der
Friedrich-Schiller-Universität Jena Erlanger Allee 101
D-07747 Jena
Dr.-Ing. Ulrich Holzwarth Med-Titan
Henkestr. 91 D-91052 Erlangen Prof. Dr. med. Dipl.-Ing.
Volkmar Jansson Orthopädische Klinik, Klinikum Großhadern Marchioninistr. 15 D-81377 München Dipl.-Ing. Christian Kliewe
Lehrstuhl für Konstruktionstechnik/
CAD
Universität Rostock Albert-Einstein-Str. 2 D-18059 Rostock Prof. Dr. Sabine Kloth TÜV SÜD
Product Service GmbH Ridlerstr. 65
D-80339 München Dipl.-Ing. Daniel Klüß
Orthopädische Klinik und Poliklinik, Universität Rostock
Doberaner Str. 142 D-18057 Rostock
Dr. med. dent. Dr. med. Andreas Kolk Klinik für Mund-,
Kiefer- und Gesichtschirurgie TU München
Ismaninger Str. 22 D-81675 München Dr. med. Florian Krug
Orthopädie und Unfallchirurgie, AK Eilbek
Friedrichsberger Str. 60 D-22081 Hamburg Loosli Yannick M.Sc ETH Dr. h. c. Robert Mathys Bischmattsr. 12 CH-2544 Bettlach Dr. med. Michael Maier BG-Unfallklinik Murnau Prof.-Küntscher-Str. 8 D-82418 Murnau
Florian Matl
Institut für Experimentelle Onkolo- gie und Therapieforschung der TU München
Ismaninger Str. 22 D-81675 München
Dipl.-Ing. Thomas Oberbach Mathys Orthopaedie GmbH An den Trillers Bueschen 2 D-07646 Moersdorf
Dipl.-Ing. (FH) Andreas Obermeier Institut für Experimentelle Onkolo- gie und Therapieforschung der TU München
Ismaninger Str. 22 D-81675 München Dr. med. Hakan Pilge Abteilung und Poliklinik für Sportorthopädie der TU München
Conollystr.32 D-80809 München Prof. Dr. Dr. Plitz
Labor für Biomechanik und Experimentelle Orthopädie Marchioninistr. 23 D-81377 München Dipl.-Ing. Dirk Pohle
Friedrich-Alexander Universität Lehrstuhl für Polymerwerkstoffe Martensstr. 7
D-91058 Erlangen Dipl.-Biol. Sabine Ponader Mund-, Kiefer- und Gesichtschirurgische Klinik Friedrich-Alexander-Universität Glückstraße 11
D-91054 Erlangen Dipl.-Ing. (FH) Jan Reich Aesculap AG & Co.KG Am Aesculap-Platz D-78532 Tuttlingen PD Dr. med. Martin Rudert Klinik für Orthopädie und Sportorthopädie, TU München
Ismaninger Str. 22 D-81675 München Prof. Dr. med. Jörg Scholz Heliosklinikum
Emil von Behring - Stiftung Oskar Helene Heim
Walterhöfer Str. 11 D-14165 Berlin
Dr.-Ing. Ulrich Schreiber Klinik für Orthopädie und Unfallchirurgie, Abt. Biomechanik Connollystr. 32 D-80809 München
PD Dr. med. habil. Alexander Schuh Orthopädische Klinik Wichernhaus Rummelsberg 71
D-90592 Schwarzenbruck Prof. Dr.-Ing. Erwin Steinhauser Fakultät Feinwerk- und Mikrotechnik, Physikalische Technik, FH München Lothstr. 34
D-80335 München
Prof. Dr. rer.nat. Axel Stemberger Institut für Experimentelle Onkologie und Therapieforschung
der TU München Ismaninger Str. 22 D-81675 München
Prof. Dr. med. Ulrich Stöckle Abt. für Unfallchirurgie der TU München Ismaninger Str. 22 D-81675 München Dr.-Ing. Marcus Stoffel
Institut für Allgemeine Mechanik, RWTH Aachen
Templergraben 64 D-52056 Aachen
Prof. Dr. med. Peter Thomas
Klinik und Poliklinik für Dermatologie und Allergologie
LMU München Frauenlobstr. 9-11 D-80337 München
Univ.-Prof. Dr.-Ing. Roger Thull Lehrstuhl für Funktionswerkstoffe der Medizin und Zahnheilkunde
der Universität Würzburg Pleicherwall 2
D-97070 Würzburg
Dr. med. Rüdiger von Versen DIZG - German Institute for Cell and Tissue Replacement,
Koepenicker Str. 325, Haus 42 D-12555 Berlin
Dipl.-Math. Jan Christoph Wehrstedt Zentrum Mathematik
TU München Boltzmannstr. 3 D-85748 Garching
Wir bedanken uns bei folgenden Firmen für ihre Unterstützung:
B. Akra, D. Liepsch, S. Moravec, M. Stock
Strömungsuntersuchungen zur Beurteilung des hämodynamischen Verhaltens eines Polyurethangerüstes für das “Tissue Engineering” von Herzklappen
Für den Ersatz von Herzklappen in Aortenposition stehen heute grundsätzlich drei verschiedene Typen von Ersatzklappen zur Verfügung: mechanische, biologische und Homografts. Alle drei Typen besitzen gute hämodynamische Eigenschaften, sind aber auch verbunden mit spezifischen Limitationen.
Mechanische Herzklappen halten zwar den starken Belastungen auf Dauer stand, weisen aber eine hohe Thrombogenizität auf, so dass eine lebenslange Antikoagulation erforderlich ist, mit dem Risiko von inneren Blutungen.
Biologische Herzklappen sind den natürlichen Herzklappen sehr ähnlich. Sie bestehen aus einem Kunststoffgerüst mit tierischem Bindegewebe, was eine Antikoagulation unnötig macht. Allerdings ist die Lebensdauer dieser Klappen auf 10-15 Jahren begrenzt.
Homografts sind menschliche Herzklappen. Diese Klappen können aus einem explantierten Herzen eines Patienten mit dilatativer oder ischämischer Kardiomyopathie oder auch aus Spenderherzen, die nicht für eine Herztransplantation verwendet werden können, gewonnen werden. Homografts werden dann durch Kryokonservierung über flüssigem Stickstoff für eine nahezu unbegrenzte Zeit gelagert. Bei Patienten, denen ein Homograft implantiert wurde, sind gerinnungshemmende Medikamente nicht notwendig.
Jedoch müssen diese Patienten nach durchschnittlich 15 Jahren mit einer erneuten Herzoperation rechnen.
Klinische Erfahrungen und experimentelle Studien haben gezeigt, dass endothelialisiertes Biomaterial zum einen eine weitaus längere Haltbarkeit, zum anderen eine wesentlich geringere Thrombogenizität aufweist. Im Rahmen dieser Arbeit werden nicht resorbierbare Polyurethangerüste für das "Tissue Engineering" von Herzklappen hergestellt. Hierfür wird eine Abgussform aus einer menschlichen Aortenherzklappe gemacht.
Diese Abgussform dient zunächst zur Anfertigung der Polyurethangerüste. Weiterhin werden diese Konstrukte mit Kollagen beschichtet, um die Zellbesiedelung zu simulieren. Strömungsversuche mit LDA und PIV- Systemen werden sowohl an den beschichteten Herzklappengerüsten, als auch an den gesunden Homografts durchgeführt, um die exakten 3D- Strömungsprofile zu bekommen. Die Ergebnisse der Strömungsversuche dienen dann zur Verbesserung der Form und des Designs der PU-Konstrukte. Das Forschungsvorhaben liefert ein strömungsoptimiertes Herzklappengerüst der durch die Besiedelung mit körpereigner venösen Zellen, eine Fremdkörperreaktion umgeht.
Korrespondenzanschrift Bassil Akra M.Sc.
Herzchirurgische Klinik
Klinikum der Universität München Marchioninistr. 15
D-81377 München
U. Böhling, J. Scholz
Navigationsverfahren zur Optimierung der Implantation von Femurkappen-Endoprothesen
Einleitung
Ziel der Entwicklungsarbeit und klinischen Prüfung war es, Optimierungsmöglichkeiten der chirurgisch präzisen Implantation einer Femurkappen-Endoprothese unter Ausnutzung verschiedener Parameter zu prüfen und zu bewerten.
Material und Methode
Verwendet wird zu diesem Zweck ein CT-freies Navigationssystem. Nach initialer Kallibrierung des Systems mithilfe des Matching der im Knochen verankerten Rigid-Bodies erfolgt die Erfassung anatomischer Landmarken. Zu diesem Zweck werden die Femurcondylen sowie die Anteile des proximalen Femur erfasst, um eine präzise Achsausrichtung und anatomische Ausrichtung der Winkelverhältnisse des proximalen Femur wiederzugeben. Das Bone-Morphing der Oberfläche repräsentiert sodann die Dimension und räumliche Ortung von Femurkopf und Schenkelhals.
Über einen eigens für dieses Verfahren entwickelten Algorhythmus werden sodann orientiert an Femurkopf und Schenkelhals graphische Darstellungen in dreidimensionaler Ebene entwickelt, die es ermöglichen, eine intraoperative Planung anhand drei unterschiedlicher Planungs-vorschläge vorzunehmen. Es erfolgt einerseits die eine Ausrichtung am Femurkopf.
Des weiteren eine mögliche Ausrichtung am Schenkelhals. Und drittens eine mögliche Ausrichtung am Schenkelhals einschließlich einer um 5° valgisch eingebrachten Positionierung.
Ergebnisse
Die bisherigen virtuellen Prüfungen ermöglichen eine Visualisierung unterschiedlicher räumlicher Implantat- komponenten. Über die Erfahrungen der chirurgischen Anwendung berichten wir im Rahmen des Vortrages.
Diskussion
Die navigierte Positionierung von Femurkappe und Pfannenkomponente erlaubt die intraoperative Planung und Visualisierung unterschiedlicher Dimensionen und räumlicher Anordnungen. Eine bedeutsame Komplikationsmöglichkeit dieser endo-prothetischen Versorgung besteht in dem Notching der Implantatkomponenten. Dieses lässt sich unseres Erachtens in bedeutsamer Weise durch dieses Navigationsverfahren verbessern.
Korrespondenzanschrift HELIOS Klinikum Emil von Behring
Klinik für Orthopädie, Stiftung Oskar-Helene-Heim Walterhöfer Straße 11
D-14165 Berlin
G.H. Buchhorn, P. Bersebach, W. Schultz
Die Menge von PMMA - Abschliff bei aseptischer Lockerung einzementierter Femurschäfte (Typ CF-30) – eine Volumenabschätzung anhand von Reoperationspräparaten
Amount of PMMA wear liberated in aseptic loosening of cemented femoral stems (type CF- 30) – a volumetric estimate based on retrieved samples
Einleitung
Die Ermüdung von PMMA-Knochenzementköchern ist ein wesentlicher Aspekt der aseptischen Lockerung ze- mentierter Endoprothesenteile. Die Relativbewegungen gegen den Knochen und das Implantat führen zu Ab- schliff der Oberflächen. Freigesetzte Partikel lösen die als „cement disease“ beschriebenen Fremdkörper- reaktionen aus. Messungen des in vivo freigesetzten PMMA-Abriebvolumens sind nicht bekannt.
Material und Methode
Revisionspräparate von Hüftgelenk-Totalendoprothesen Typ CF-30 wurden nach Lagerung in Formalinlösung gereinigt und in Raumluft getrocknet. Den distalen CF- 30 Schaft zeichnet seine symmetrische, doppelt-konische Gestalt (ca. zwei Drittel der Schaftlänge) mit recht- winkligem Querschnitt aus. Die Zementköcher wurden aus den Fragmenten auf den Metallschäften rekonstruiert und die Position der Fragmente vermessen. Politur und Materialabtrag auf den den Schäften zugewandten Ober- flächen wurden kartografiert. Segmente von ca. 0,2 mm Stärke wurden rechtwinklig zur Symmetrieachse des Schaftes geschnitten und bei bekanntem Maßstab mor- phometriert. Ein durch Abschliff entstandener Defekt wurde durch eine Dreiecksfläche approximiert.
Abb.: Schliff mit Defekt und markierten Schaft- positionen vor und nach (gestrichelt) der Lockerung Aus mindestens zwei Dreiecksflächen, deren bekannten Abstand und unter der Annahme linearer Körperkanten lassen sich Verschleißvolumina berechnen. Zur Beurteilung der Lageveränderungen der Schäfte, der Lokalisation und des zeitlichen Auftretens von
Zementbrüchen sowie zur Identifikation von Fragmenten wurden Standard Röntgenbilder herangezogen.
Ergebnisse
Von 35 Revisionspräparaten eigneten sich 22 Zement- köcher zur Analyse. Das Patientenkollektiv zeichnete sich nicht durch Besonderheiten aus. Die Prothesen waren durchschnittlich 5 Jahre (2,6 – 8,3) implantiert.
Als mittlere Dauer des Materialabtrages wurde die Zeit von Schmerzbeginn bis Revision angenommen, diese betrug im Mittel 28 Monate (8 – 78).
Die Approximation der Flächen durch Dreiecke be- schreibt nicht die nach medio-dorsal gerichtete Rotation der Schäfte. Die nur auf Messwerten beruhenden Volumina betrugen unabhängig von der jeweiligen Schaftgröße im Mittel 166,57 mm³ (0,85 – 494,10).
Diskussion
Der Schafttyp CF-30 stellt eine Sonderform dar, deren konischer Anteil und Querschnitt bei den modernen Im- plantaten nicht in dieser ausgeprägten Weise enthalten sind. Die scheuernde Oberfläche moderner Schäfte ist in der Regel nicht geringer; aggressive Kanten und Keil- formen werden aber vermieden.
Der Mittelwert der gemessenen Volumina entspricht einer Menge von 0,196 g Abriebpulver (0,001 – 0,583) (spez. Gewicht Ȣ (PMMA) = 1,18 gycm-3). Bei einem mittleren Partikelvolumen von 1 µm³ erhält man eine Anzahl von ca. 1,7y10E14 Partikeln. Angesichts der kur- zen Dauer der Scheuerbewegungen sind die Überlastung des Kontaktgewebes und das Ausmaß des Knochen- abbaus vorstellbar.
Die wesentlichen Fehler der beschriebenen Methode (z.B. Flächendetektion, Fehllage der Schnittebene) be- dingen eine zu kleine Partikelmenge. Die Abschliff- volumina der kontralateralen Seite konnten nicht erfasst werden. Unter Berücksichtigung der gesamten Schaft- länge können die tatsächlich abgeschliffenen Mengen nach ersten Abschätzungen das Drei- bis Vierfache der ermittelten Werte betragen. Weitere Untersuchungen werden dieser Fragestellung nachgehen.
Aufgeraute Metallschäfte erzeugen große Mengen Abrieb. Nach Feststellung einer Implantatlockerung sollte der Zeitpunkt eines Implantatwechsels nicht unnötig hinausgezögert werden.
Korrespondenzanschrift Dipl..-Ing. Gottfried H. Buchhorn
Biomaterial Labor, Abteilung Orthopädie der UMG Georg-August-Universität Göttingen
Robert-Koch-Str. 40, D- 37075 Göttingen Mail: gh-buchh@med.uni-goettingen.de
P. Diehl, R. Wimmer, J. Auernheimer, H. Kessler, M. Schmitt, W. Mittelmeier, U. Magdolen
In-vitro-Effekt von mit zyklischen RGD-Peptiden beschichteten humanen Knochen auf das Wachstum primärer humaner Osteoblasten und Endothelzellen der Nabelschnur
Growth promoting in vitro effect of synthetic cyclic RGD-Peptides on human osteoblast-like and endothelial cells attached to cancellous bone
Einleitung
Im Bereich des Tissue Engineering gewinnt die Biofunktionalisierung von medizinischen Implantaten mit zum Beispiel an Integrine bindenden RGD-Peptiden zunehmend an Interesse. Durch entsprechende Beschichtung von Implantaten könnte es durch Zellen wie Osteoblasten und Endothelzellen, die via Integrine an diese Peptide binden zu einer verbesserten Osteointegration kommen. Für die Rekonstruktion von größeren Knochendefekten werden bisher unter anderem Allografts verwendet. Bei der hierbei notwendigen Vorbehandlung zur Sterilisation, wie Bestrahlung oder Autoklavierung, kommt es zwangsläufig zum Verlust biomechanischer und biologischer Eigenschaften.
Ziel der vorliegenden Arbeit war es den in vitro-Effekt von humanen mit zyklischen RGD-Peptiden beschichteten spongiösen Knochenzylindern auf das Wachstum primärer humaner Endothelzellen (HUVEC) und Osteoblasten zu untersuchen.
Material und Methode
Dazu wurden aus humanen Schenkelhälsen nach Hüftendoprothesenimplantation gewonnene Knochenzylinder (Durchmesser 7mm; Höhe 2-3 mm) nach thermischer Desinfektion mit dem Marburger Knochenbank-System (Lobator sd-2) mit synthetischen zyklischen RGD-Peptiden (vier Phosphonatankern) über Nacht bei 4° C inkubiert. Im Anschluß wurden die Explantate mit primären humanen Knochenzellen (10.000 Zellen/Zylinder) oder Endothelzellen (80.000 Zellen/Zylinder) besiedelt und für 8 bzw. 6 Tage in Dulbecco’s modified Eagle’s Medium bzw M199- Medium kultiviert. An Tag 1 und 6 bzw.8 Tag wurden Zellvitalität, Zellproliferation und Zelladhäsion an Knochenmatrix bestimmt. Ergänzend erfolgten histologische und immunhistologische (Alkalische Phosphatase, Osteocalcin und Kollagen I) Untersuchungen der mit RGD-Peptiden beschichteten und mit primären humanen Knochenzellen versetzten Knochenpräparate. Als Kontrollgruppe dienten auf unbehandelten Knochenzylindern ausgesäte Knochen- und Endothelzellen
Ergebnisse
Durch die Beschichtung der Knochenpräparate mit den RGD-Peptiden kam es zu einer signifikanten Steigerung der Knochen-und Endothelzellproliferation bis zu 42%
im Vergleich zur unbehandelten Kontrollgruppe.
Diskussion
Eine Schlüsselfunktion für das Einwachsverhalten von Auto- und Allografts besitzen unter anderen Osteoblasten und Endothelzellen. Aus diesem Grund wurde in ersten Versuchen humaner gereinigter Knochen mit RGD-Peptiden beschichtet. Es konnte gezeigt werden, dass die in vitro Besiedelung mit primären humanen Osteoblasten durch diese
„Biofunktionalisierung“ stimuliert wird. .Ein zentrales Problem beim verzögerten Einwachsen von sterilisiertem Knochenmaterial ist in der unzureichenden Gefäßneubildung zu sehen. Hier könnte die RGD- Beschichtung der Oberfläche einen positiven Effekt hinsichtlich der Gefäßneubildung und damit auf den Heilungsprozess insgesamt haben, denn auch Endothelzellen binden an RGD-Peptide. Diese ersten Ergebnisse geben Hinweis darauf, daß sich die Osteointegration von Allografts durch die Beschichtung mit RGD-Peptiden vor Implantation, besonders an der Grenzfläche zum intakten Knochen, wesentlich verbessern lassen könnte.
Literatur
[1]Magdolen U, Auernheimer J, Dahmen C, Schauwecker J, Gollwitzer H, Tubel J, Gradinger R, Kessler H, Schmitt M, Diehl P. Growth promoting in vitro effect of synthetic cyclic RGD-peptides on human osteoblast-like cells attached to cancellous bone. Int J Mol Med. 2006 Jun;17(6):1017-21.
[2]Auernheimer J, Dahmen C, Hersel U, Bausch A, Kessler H. Photoswitched cell adhesion on surfaces with RGD peptides. J Am Chem Soc. 2005 Nov 23;127(46):16107-10.
[3] Steinhauser, Erwin; Liebendorfer, Adelheid; Enderle, Anja; Bader, Rainer; Kerschbaumer, Susanne; Brill, Thomas; Busch, Raymonde; Gradinger, Reiner
In Vivo-Study of the Osseous Integration of RGD Coated and Uncoated Metallic Implants Materialprufung. Vol. 47, no. 4, pp. 197-202. 2005.
Korrespondenzanschrift Dr. Peter Diehl
Orthopädische Klinik und Poliklinik der Universität Rostock
Doberanerstr. 142 D-18057 Rostock
S. Eberle, C. Gerber, P. Augat
Evaluierung des dynamischen Versagens von Gamma3-Nägeln mit Hilfe der FEM Evaluation of the dynamical failure of Gamma3-Nails using FEA
Einleitung
Zur Fixierung von proximalen Femurfrakturen werden bei instabilen Frakturen intramedulläre Kraftträger, wie zum Beispiel Gamma3-Nägel, verwendet. Bei ausbleibender oder verzögerter Heilung werden die Implantate über 6-12 Monate zyklisch belastet, was zu einem dynamischen Versagen des Implantats führen kann. Ziel dieses Projekts war deshalb die Evaluierung des dynamischen Versagens von Gamma3-Nägeln durch axiale Belastung mit Hilfe der Finite-Elemente-Methode.
Material und Methode
Zur Bestimmung von Ort und Betrag der höchsten von- Mises-Spannung in einem Gamma3-Nagel wurde der Versuch von Latta [2] (Abb. 1 links und Mitte) in einem FE-Modell (Abb. 1 rechts) nachgebildet. Das als statische Kraft aufgebrachte median fatigue limit1wurde eigenen Versuchen entnommen. Die Kontakte in Implantat und Versuchsaufbau wurden vollständig berücksichtigt. Die Krafteinleitung und Einspannung über Kardangelenke wurde mechanisch korrekt über gesperrte Freiheitsgrade abstrahiert. Zur Minimierung der Rechenzeit wurde das FE-Modell halbsymmetrisch aufgebaut.
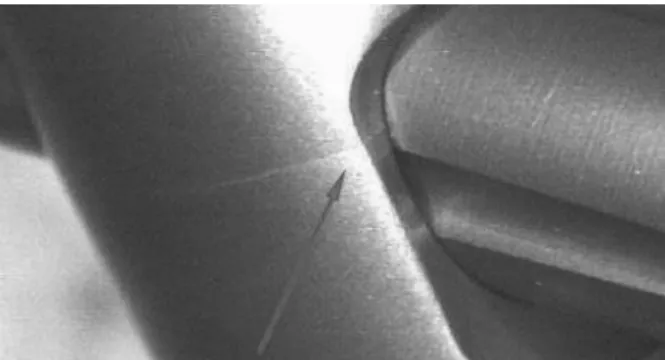
Abb. 1: (vlnr.) Schematische Skizze, Aufbau und FE- Modell des Latta-Tests.
Der Ort der höchsten von-Mises-Spannung wurde mit den Orten der Rissentstehung, die im Experiment beobachtet wurden, verglichen.
Ergebnisse
Abb. 2: Halbschnitt des Nagels mit dem Ort der höchsten Vergleichsspannung auf der Zugseite der Bohrung.
1 Axiale Kraft, bei der der Nagel nach 500.000
Der Ort der höchsten von-Mises-Spannung auf der Zugseite des Nagels befindet sich erwartungsgemäß in der Kerbe für die Bohrung der Schenkelhalsschraube (Abb. 2). Die Simulation zeigte, dass diese Stelle mit dem Ort der Rissentstehung am Nagel (Abb. 3) aus dem Versuch nahezu übereinstimmt. Der Betrag der Spannung liegt bei 90% der unteren Streckgrenze der verwendeten Titanlegierung. Für das dynamische Versagen eines Bauteils dieser Legierung bei 500.000 Lastzyklen muss eine Spannung von mehr als 63% der unteren Streckgrenze auftreten [1]. Die berechnete Spannung würde also zum dynamischen Versagen führen.
Abb. 3: Riss, ausgehend von der Kerbe der Schenkelhalsschraubenbohrung.
Diskussion
Die hohe berechnete Vergleichsspannung lässt auf ein noch zu steif idealisiertes FE-Modell schließen. Durch fehlende Messungen der Dehnungen im Versuch kann ein exakter Vergleich mit dem FE-Modell jedoch nicht durchgeführt werden. Die Dehnungs- und daraus resultierende Spannungsmessung soll in weiteren Versuchen ergänzt werden. Eine Validierung des FE- Modells und eine genauere Evaluierung des Versagens wäre somit möglich.
Literatur
[1] Dindorf C.: Ermüdung und Korrosion nach mechanischer Oberflächenbehandlung von Leichtmetallen, TU Darmstadt, Diss., 2006
[2] Milne E. L., Latta L. L.: Biomechanical testing of Femoral Intramedullary Devices, University of Miami, School of Medicine, December 1999.
Korrespondenzanschrift Sebastian Eberle
BG Unfallklinik Murnau Biomechanik Forschungslabor Professor-Küntscher-Str. 8 D-82418 Murnau
M. Geisendorf , A. Birrer, G. Sutter, P. Heuberger
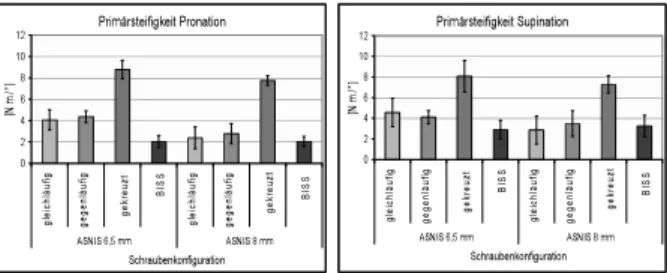
F
DȦ
Į
trapezial
metacarpal
Abbildung 1: Lastfall
Simulation von Protheselockerungen am Daumensattelgelenk
Einleitung
Die Hauptproblematik beim Versagen von Daumensattelgelenksendoprothesen liegt hauptsächlich in der proximalen Verankerung im Os trapezium.
Implantatlockerungen sind dabei die häufigste Ursache, die eine Revision unabdingbar macht. Ziel dieser Arbeit war es, mit einem Testsetup und der entsprechenden Messtechnik, Lockerungserscheinungen zu simulieren und dabei die auftretenden Mikrobewegungen zu messen. Es wurde ein Instrument zur Untersuchung unterschiedlicher Implantattypen auf deren Lockerungsverhalten hin geschaffen.
Material und Methode
Für die Untersuchungen wurden zwei Endoprothesen der Firma MOJE Keramik-Implantate verwendet. Die „alte“
MOJE-Keramik CMC1 Endoprothese mit den Seriennummern 51-… / 52-… und die „neue“ ACAMO- CMC-1 Endoprothese mit den Seriennummern 53-… / 54-… Die beiden Kugelgelenksimplantate unterscheiden sich in ihrer Anordnung der Protheseköpfe und –Pfanne.
Die neue Endoprothese ist invers zur alten angeordnet, d.h. der Kopf ist im Os trapezium verankert. Bei der älteren Version liegt das Drehzentrum folglich distal, ausserhalb des Os trapeziums und bei der neuen Version weiter proximal im Os trapezium. Weiter liegen unterschiedliche Schaftlängen und Durchmesser vor, die jedoch bei beiden Typen gleich sind. Beim gewählten Lastfall handelt es sich um das dynamische Abfahren eines Zirkumduktionskegels unter axialem Druck.
(Abb. 1)
Als Knochenersatzmaterial wurde ein Polyurethanschaum verwendet, in welchem die Implantate verankert wurden. Zu den Versuchsparametern zählten nebst dem Design auch der Öffnungswinkel Įdes Zirkumduktionskegels (30°-60°), der Betrag der Druckkraft FD (max. 90N) und die Schaumdichte des Polyurethans (15 pcf -20pcf).
Zur Erfassung der Relativbewegung zwischen Implantat und Knochen diente eine eigens entwickelte Dreiachsen- DMS-Applikation, die es erlaubte die Präzision von
±5µm auf einen Verfahrweg von 0.5mm einzuhalten.
Um die effektive Relativbewegung zu gewinnen, wurde jeweils die Bewegungsdifferenz von Implantat und Polyurethanschaum gemessen. Abb. 2 zeigt die Messeinheit.
Ergebnisse und Diskussion
Die erhaltenen Resultate zeigen, dass die ältere Protheseversion im Versuch unter gleichen Bedingungen im Os trapezium eher zu lockern beginnt, als dies bei der neuen Version der Fall ist. Dieses Verhalten liess sich grundsätzlich bei jeder untersuchten Parameterwahl beobachten. Die Erklärung für diesen Fakt liegt in der unterschiedlichen Krafteinleitung von Implantat auf Knochen und umgekehrt. Bei der alten Version sind die aufzunehmenden Lagermomente durch die exponierte Lage des Drehzentrums grösser als bei der neuen Version.
Messeinheit Z-Achse
Messeinheit Y-Achse Messeinheit X-Achse Knochenersatzmaterial (Polyurethanschaum)
Implantat
Abbildung 2: Messeinheit
M. Geisendorf , A. Birrer, G. Sutter, P. Heuberger
Die inverse Anordnung von Kugelpfanne und Kugelkopf beim neuen Design führt jedoch zwangsläufig zu einer höheren Beanspruchung der Verankerung im Os metacarpale I. Dies ist aber angesichts der möglichen Verankerungsart im Röhrenknochen viel unproblematischer als im Os trapezium, wo nur wenig Knochenmaterial zur Verfügung steht. Das neue Design führt folglich zu einer, der Verankerungsmöglichkeit angepassten, Belastungsverteilung.
Die im Verhältnis geringere Belastung und die damit einhergehende kleinere Relativbewegung sind hauptverantwortlich für die Entstehung einer langfristig ausreichenden Sekundärstabilität.
Weiter hat sich erwiesen, dass die eingesetzte Messmethodik zur Detektierung von Relativbewegungen im Mikrobereich geeignet ist.
Literatur
[1] J. B. Brunski, Dent Implantol. Update, 4, 77 (1993) [2] M. Jasty, C. Bragdon, D. Burke, D. O`Conner, J. Lowenstein and W. H. Harris,
J Bone Joint Surg Am, 79, 707 (1997)
[3] S. Szmuklar-Moncler, H. Salama, Y. Reingewirtz and J. H. Dubruille,
J Biomed Mater Res, 43, 192 (1998).
Korrespondenzanschrift Markus Geisendorf
Zürcher Hochschule Winterthur Institut für mechanische Systeme Technikumstrasse 9
CH-8401 Winterthur
U. Gersbach, N. Gronau, J. Prosek
Belastungsvergleich der XSCREW™ in unterschiedlichen Indikationen Load Comparison of the XSCREW™ for Different Indications
Introduction
The XSCREW (Zimmer GmbH) is a new system intended for use in stabilising bone fractures of the upper extremities. The design of this screw includes, depending on the length, up to nine cross sectional holes for the placement of surgical pins (K-wires). The first two holes (from the screw head) are drilled at an angle of 45° in relation to the screw axis and the others are perpendicular. With a radiolucent target device, XSCREW is a minimally invasive solution (MIS) for the distal radius or the olecranon. The goal of this investigation was to analyse the most critical load situation for the XSCREW and compare it to alternative surgical repairs (predicates) and in-vivo loads.
Distal Radius XSCREW
MIS Target Device Target Sleeve Possible K-Wires Fig.1 XSCREW with MIS target device
Materials and Methods
Three tests were performed to estimate a failure load of the XSREW system for the different indications, wrist, triceps and biceps loading. In each test, a simplified polyethylene (PE) test specimen was used. In the first test a wrist load FW parallel to the radial axis with an offset from the centreline to the farthest ulnar cortex was simulated (Fig.2).
Fig.2 Wrist load Situation and Testing
In the second test, a pulling force FTof the triceps at the olecranon was simulated (Fig.3).
Fig.3 Triceps Load Situation [1] and Testing
For the third test, the humeral reaction force FHproduced by the load of the biceps was the test load. When the
forearm is positioned with 90° of flexion the humeral reaction force FHis perpendicular to the ulnar axis and pushes directly to the olecranon (Fig.4).
Fig.4 Biceps Load Situation [1] and Testing
In the three load situations the test specimens were loaded as shown in Fig.2, Fig.3 and Fig.4 at a constant displacement rate of 5 mm/min until a failure of the implant occurred. Similar tests were conducted on simulated fracture repairs using Cerclage wiring of the olecranon, and the small oblique T-plate (Zimmer GmbH) in the radius in order to compare the failure loads. In-vivo loads for the wrist were calculated according to a half BW push of the forearm while rising from a chair. For the triceps and the biceps load situation, in-vivo loads were calculated according to the models (Fig.3 and Fig.4) of Nordin et al. [1] with 5 kg of hand load.
Results and Discussion
The results of the static tests showed that for all the load situations, the strength of the XSCREW was above the biomechanically calculated maximum joint load.
Additionally, the strength of the XSCREW was higher than the predicates tested for all the load situations.
Test Ratio XSCREW/
Predicates Ratio Test/
Calculation
Wrist 4.68 5.19
Triceps 1.40 3.24
Biceps 1.33 1.16
Table 1 Results of the Comparisons Conclusions
The biceps load situation represents the worst-case loading condition for the XSCREW. However, the static strength of the XSCREW is higher than that of the predicates and the expected in-vivo loads.
References
[1] M. Nordin and V.H.Frankel, Basic Biomechanics of the Musculoskeletal System ( Third Edition 2001) Korrespondenzanschrift
Urs Gersbach Zimmer GmbH
Sulzer-Allee 8, P.O.Box CH-8404 Winterthur
F
WF
TF
HFracture Line
Fracture Line
F
TF
HM. Haenle, F. Heidenau, R. Bader, W. Mittelmeier, H. Gollwitzer
Eine biokompatible und antibakterielle Titanoxidbeschichtung für medizinische Implantate mit Wirksamkeit gegen antibiotikaresistente Bakterien
Einleitung
Implantat-assoziierte Infektionen stellen ein zentrales Problem bei der Implantation von Biomaterialien dar.
Für den endoprothetischen Gelenkersatz nach der Resektion von Knochentumoren wurden gar Infektionsraten von bis zu 35% angegeben [1].
Mittlerweile zeigt sich außerdem eine signifikante Zunahme an antibiotikaresistenten Hospitalkeimen nach Endoprothesen-Implantation [4]. Da die meisten Infektionen durch eine bakterielle Besiedelung des Biomaterials während oder kurz nach der Implantation entstehen, könnten antibakteriell wirksame Oberflächen durch Prävention der bakteriellen Adhäsion zu einer deutlichen Reduktion der Infektionsrate führen.
Für eine derartige antibakterielle Titanoxidbeschichtung auf Sol-Gel-Basis konnte bereits eine ausgezeichnete antibakterielle Wirksamkeit bei gleichzeitig guter Biokompatibilität nachgewiesen werden [3]. Ziel der vorliegenden Arbeit war nun die Untersuchung der Wirksamkeit gegenüber antibiotikaresistenten Bakterien.
Material und Methode
Für die in vitro Versuche wurden TiAl6V4 Plättchen (d=1,9cm) verwendet, die in einem Tauchprozess im Sol-Gel-Verfahren mit einer Titanoxid-Schicht (TiO2) beschichtet wurden. Während des Herstellungsprozesses wurden dem Sol Kupferionen zugefügt und dadurch einfach (1xCu-TiO2), zweifach (2xCu-TiO2), dreifach (3xCu-TiO2), und vierfach (4xCu-TiO2) Kupfer-TiO2- beschichtete Plättchen hergestellt. Als Kontrolle dienten unbeschichtete TiAl6V4 Plättchen. Als Keim wurde ein Methicillin resistenter Stamm von Staphylococcus aureus (MRSA, ATTC 27065) verwendet. Dieser wurde aus einem Isolat, gewonnen bei der Entfernung einer infizierten Endoprothese, kultiviert. Nach einem Modell von Christensen et. al. [2]wurden die Plättchen für 24h in bakterienhaltigem Nährmedium inkubiert. Im Anschluss wurden die Kolonie bildenden Einheiten (KBE) aus dem Überstand der Nährlösung bestimmt. Die oberflächenadhärenten Keime wurden mittels Ultraschall abgelöst und ebenfalls quantifiziert.
Ergebnisse
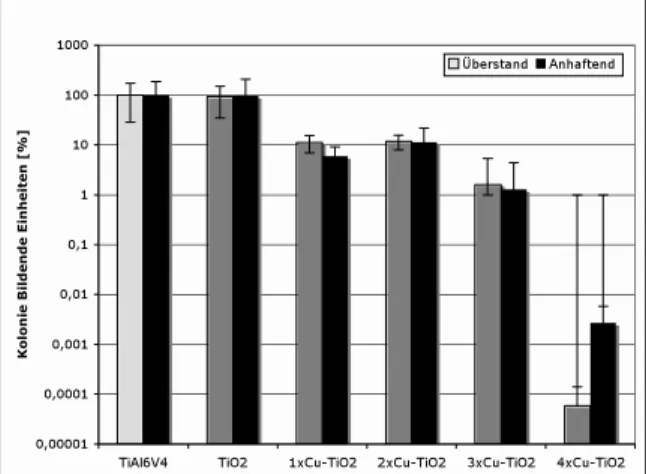
Die reine TiO2-Beschichtung zeigte im Vergleich zu den unbeschichteten Metallplättchen keinen anti-bakteriellen Effekt. Die Integration von Kupferionen in die TiO2- Schicht bewirkte jedoch eine signifikante Verminderung der vitalen Bakterien an der Plättchenoberfläche, als auch im Überstand (p < 0,05, Mann-Whitney-Test). Der beobachtete antibakterielle Effekt war bei der 4xCu- TiO2-Beschichtung mit einer Reduktion der Bakterienzahl um durchschnittlich 105 KBE am ausgeprägtesten (Abb. 1).
0,00001 0,0001 0,001 0,01 0,1 1 10 100 1000
TiAl6V4 TiO2 1xCu-TiO2 2xCu-TiO2 3xCu-TiO2 4xCu-TiO2
KolonieBildendeEinheiten[%]
Überstand Anhaftend
Abb. 1: Wachstum von MRSA 27065 auf der Oberfläche von TiO2-beschichteten sowie unbeschichteten TiAl6V4 Plättchen sowie im Überstand des Nährmediums (jeweils n=6)
Diskussion
Der so genannte „oligodynamische Effekt“ beschreibt die schädigende Wirkung von metallischen Kationen auf die lebende Zelle. Die antibakteriellen Eigenschaften von Kupfer (in toxischen Konzentrationen) beruhen auf einer Interferenz mit der Proteinsynthese und einer Öffnung der DNA-Doppelhelix[5]. Obwohl derzeit vor allem Silberionen in klinischen Applikationen Verwendung finden, scheinen Kupferionen bezüglich ihres deutlichen antibakteriellen Effekts und vergleichsweise geringen zytotoxischen Potenzials [3]
für klinische Anwendungen hervorragend geeignet.
Gerade die Biokompatibilität ist für die Infektresistenz und Integration medizinischer Implantate entscheidend und muss insbesondere bei antiinfektiösen Oberflächen beachtet werden.
Vorherige Untersuchungen konnten bereits die in vitro Zytokompatibilität der TiO2-Schicht und deren antibakterielle Eigenschaften aufzeigen [3]. Unsere neuen Ergebnisse bestätigen nun das erweiterte Spektrum dieser antiinfektiösen Oberflächen- beschichtung mit Wirksamkeit gegen antibiotika- resistente Bakterien. Bezüglich der erhaltenen Biokompatibilität und des breiten Wirkspektrums erscheint die vorliegende Schicht besonders für Revisions- oder Tumorendoprothesen, aber auch für Pins für Fixateure geeignet.
M. Haenle, F. Heidenau, R. Bader, W. Mittelmeier, H. Gollwitzer
Literatur
[1] Ahrens H., Goheger G., Streibürger A., Geber C., Hardes J.: Antimikrobielle Silberbeschichtung von Tumorprothesen. Onkologe 12, 145-151, 2006
[2] Christensen G.D., Baldassari L., Simpson W.A.:
Methods for Studying Microbial Colonization of Plastics. Methods Enzymol. 253, 477-500, 1995
[3] Heidenau F., Mittelmeier W., Detsch R., Haenle M., Stenzel F., Ziegler G., Gollwitzer H.: A novel antibacterial titania coating: metal ion toxicity and in vitro surface colonization. J. Mater. Sci. Mater. Med. 16, 883-888, 2005
[4] Ip D., Yam S.K., Chen C.K.: Implications of the changing pattern of bacterial infections following total joint replacements. J. Orthop. Surg. 13, 125-130, 2005 [5] Thurman R.B., Gerba C.P. The molecular mechanisms of copper and silver ion disinfection of bacteria and viruses. Crit. Rev. Env. Control 18, 295- 315, 1989
Korrespondenzanschrift Maximilian Haenle
Orthopädische Klinik und Poliklinik, Universität Rostock
Doberaner Str. 142 D-18057 Rostock
T. Harnoß, S. Eichhorn, O. Trapp, U. Schreiber, R. Burgkart, R. Gradinger
Morphologische Analyse der anatomischen Lage dreier unterschiedlicher Marknägel zur Versorgung proximaler Humerusfrakturen
Morphological Analysis of the anatomical position of three different intramedullary rods for the treatment of proximal humeral fractures
Einleitung
Zur Versorgung von Frakturen des proximalen Humerus kommen vermehrt intramedulläre Implantate zur Anwendung. Bei der Osteosynthese von Mehrkörperfrakturen (Neer II – IV) stellt die anatomische Lage der einzelnen Fragmente eine besondere Anforderung an Implantat und Operateur. Ziel der Untersuchung war daher eine morphologische Analyse dreier auf dem Markt verfügbarer Implantate zur Osteosynthese von Mehrkörperfrakturen hinsichtlich der Qualität der Schrauben- und Nagellage abhängig von der anatomischen Varianz des untersuchten Kollektivs.
Material und Methode
Ein Kollektiv von 25 Leichenhumeri (27 – 86 J., Median: 68 J.) wurde mittels CT digitalisiert. Drei gebräuchliche Marknägel zur Versorgung proximaler Humerusfrakturen (Targon PH Aesculap; T2 Stryker;
TriGen S&N) wurden mittels CAD System dargestellt.
Mittels Amira Vision wurden an den Humeri virtuell anatomische Landmarks erfasst (Collum anatomicum, Kopfdurchmesser ML; Diaphysendurchmesser) und somit reproduzierbare Dreikörperfrakturen (mod. nach Codman) erzeugt. Anschließend erfolgte die virtuelle Implantation der digitalisierten Marknägel. Die Qualität der Osteosynthese wurde anhand mehrerer Messungen quantifiziert. Bestimmt wurde die Position der einzelnen Schrauben in den Fragmenten (Abstand der Schraube zum Fragmentrand), sowie die Möglichkeit der sicheren Fassung der Tuberculum majus bzw. minus Fragmente.
Des Weiteren erfolgte die Analyse der Nagelschaftposition in der Diaphyse zur Validierung der korrekten Implantatlage ohne Beeinflussung der corticalen Diaphyse. Zusammenfassend wurde die Qualität der Osteosynthese mittels einer Bewertungsmatrix bestimmt.
Ergebnisse
Korrelierend zum Durchmesser des Collum anatomicum zeigten sich mit abnehmendem Durchmesser deutlich erschwerte Osteosynthesebedingungen. Das Fassen der Fragmente ist abhängig von Implantat und Humerus nicht immer möglich. Unterschiede der Qualität der Osteosynthese zeigten sich nicht nur abhängig von der anatomischen Situation, sondern auch vom untersuchten Implantat. So zeigten sich vor allem beim Trigen Nagel Probleme beim Fassen des Tuberculum minus Fragments aufgrund der Schraubenlage im Nagel, welches bei T2 sowie Targon PH noch möglich war.
Diskussion
Bei der Versorgung von proximalen Humerusfrakturen kann anhand der präoperativ bestimmten anatomischen Landmarks (CT / Röntgen) eine Prognose zur intraoperativen Implantatlage sowie zur Qualität der Osteosynthese abgegeben werden. Mit steigendem Durchmesser des Collum anatomicum ist die Schraubenlage in den Fragmenten bei den untersuchten Implantaten weiter vom Fragmentrand entfernt, konsekutiv ist die Gefahr des Versagens der Osteosynthese gemindert.
Abb.1: Exemplarische Darstellung eines implantierten marknagels
Literatur
[1] Resch H. et al.; Die Humeruskopfraktur;
Unfallchirurg.; 2003 Aug; 106(8):602-17
[2] Mall G. et al.; Sex Determination and estimation of stature from the longbones of the arm
Forensic Science international 117(2001) 23-30
Korrespondenzanschrift cand. med. Tobias Harnoß
Klinik für Orthopädie und Unfallchirurgie TU München Abt. Biomechanik
Connollystrasse 32 D-80809 München
K. Hoffmeier , A. Hößelbarth, G. Hofmann
Abhängigkeit der mechanischen Eigenschaften des hyalinen Knorpels vom Grad der Gonarthrose
Einleitung
Derzeit erfolgt die intraoperative Beurteilung des qualitativen und quantitativen Ausmaßes arthrotischer Knorpeldegeneration rein subjektiv. Jedoch gerade bei klinisch uneindeutigen Situationen wäre es von Vorteil, sich nicht auf ein gefühltes Ergebnis (Tasthaken) verlassen zu müssen, sondern auf ein standardisiertes, robustes Messverfahren zurückgreifen zu können.
Ziel unserer Arbeit ist es Verfahren zu entwickeln, mit denen der Zustand des hyalinen Knorpels messbar und dadurch auch dokumentierbar gemacht werden kann.
Eine zwingende Vorraussetzung dafür ist die Erarbeitung eines Zusammenhangs zwischen der Erkrankung und physikalisch messbaren Größen. Auf der Grundlage vergleichender Untersuchung von geschädigtem und gesundem Knorpel soll in einem ersten Schritt die Beurteilung der Knorpeldegeneration anhand mechanischer Messgrößen erarbeitet werden.
Material und Methode
Untersucht werden Proben unterschiedlicher Knorpel- qualität. So lassen sich aus den Gelenkflächenresektaten von Knie-TEP Patienten Proben mit den Arthrose Graden 2 und 3 entnehmen. Als Kontrollgruppe dienen die aus Leichenknien entnommenen Proben ohne erkennbare Arthrose.
Mit Hilfe eines Hohlbohrers (Durchmesser 4mm) werden zylinderförmige Proben aus den Hauptbelas- tungszonen der Femurkondylen und des Tibiaplateaus entnommen und unterhalb der chondralen Lamelle vom Knochen getrennt.
Die Untersuchung erfolgt durch einen Druckversuch bei dem die Knorpelprobe schrittweise um jeweils 2,5%
gestaucht wird und anschließend 2min relaxiert, bevor die nächste Stauchung erfolgt. Insgesamt durchläuft eine Probe 5 Kompressionsstufen bis zu einer Stauchung von
12,5%. Der Druckversuch erfolgt als „unconfined compression“, wobei die Probe permanent von PBS- Lösung umgeben ist, um ein Austrocknen während der Messung auszuschließen.
Aus den gemessenen Kraft-Weg Daten werden zwei spezifische Kenngrößen ermittelt, die im Weiteren als dynamischer Modul und statischer Modul bezeichnet werden. Äquivalent zum E-Modul berechnen sich diese aus den Parametern Spannung (Druckkraft/Fläche) und Dehnung (Stauchung) der Probe. Der dynamische Modul repräsentiert die mechanische Eigenschaft des Knorpels bei dynamischer Belastung wie zum Beispiel Laufen und wird aus dem Anstieg der Regressionsgeraden durch die Kraftmaxima der Kompressionsstufen bestimmt. Der statische Modul dagegen repräsentiert die unter quasistatischer Belastung auftretende Eigenschaft und wird aus dem Anstieg der Regressionsgeraden durch die Kraftminima der Kompressionsstufen bestimmt.
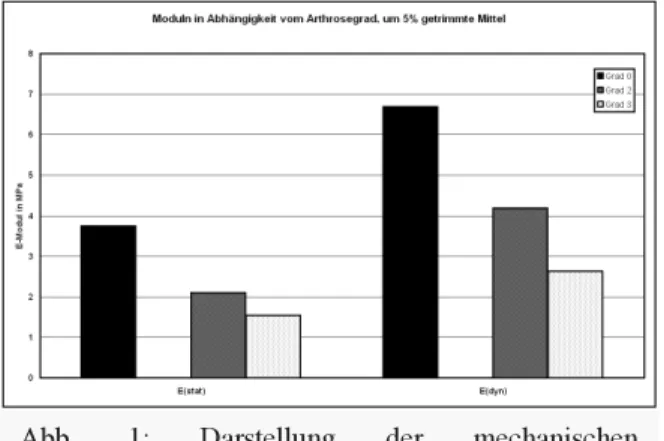
Ergebnisse
Erste Ergebnisse zeigen einen deutlich messbaren Zusammenhang zwischen Arthrosegrad und mecha- nischem Verhalten des hyalinen Knorpels. Sowohl der dynamische als auch der statische Modul nehmen mit fortschreitender Knorpeldegeneration ab. Das Verhältnis von dynamischem zu statischem Modul scheint dagegen nicht vom Arthrosegrad abhängig zu sein.
Korrespondenzanschrift Dipl. Ing. Konrad Hoffmeier
Klinik für Unfall-, Hand- und Wiederherstellungschirurgie Klinikum der Friedrich-Schiller-Universität Jena Erlanger Allee 101
D-07747 Jena Abb. 2: Ermittlung der dynamischen und statischen
Moduln aus den Kraftmaxima bzw. -minima der Dehnungsstufen 2 bis 5.
Abb. 1: Darstellung der mechanischen Eigenschaften in Abhängigkeit vom Arthrosegrad.
Grad 1 ist hier aufgrund fehlender noch nicht
U. Holzwarth, W. Hönle, J. Luyten, A. Schuh, A. Olk
Geschäumte Titanimplantatwerkstoffe, Möglichkeiten der Anwendung in Traumtologie und Orthopädie
Einleitung
Die Rekonstruktion knöcherner Defekte in der Unfallchirurgie und in der Orthopädie stellt eine Herausforderung dar, die häufig unter Verwendung von autologem oder heterologem Knochen gelöst wird. Das Hauptproblem hierbei stellt die limitierte Menge und die Morbidität an der Entnahmestelle dar. Heutzutage werden exzellente Implantate oder Ersatzstoffe zu immer günstigerer Kakulation angesichts der angespannten Situation im Gesundheitssystem gefordert. Aktuell wurde die Technologie, einen poröser Knochenersatz, VITOFOAM™ ,aus verschiedenen biokompatiblen Legierungen herzustellen, entwickelt. Die mechanischen Eigenschaften können individuell eingestellt werden und somit denjenigen des menschlichen Knochens entsprechen. VITOFOAM™ besteht aus zugelassenen Metallen, z.B. Reintitan, TiAl6V4 oder auch CoCr28Mo6, mit hochvernetzten offenen Poren (50 - 500 µm). Die Porosität ist weitestgehend einstellbar und beträgt in aller Regel zwischen 50 und 80 %. Ziel unserer Studie ist es zu untersuchen, inwieweit Reintitan oder die Legierung TiAl6V4 als poröses Trägermaterial geeignet ist, als Knochenersatz in der orthopädischen bzw. traumatologischen Chirurgie eingesetzt zu werden.
Material und Methode
Probekörper aus Reintitan und TiAl6V4 mit einer Porengröße von 150 bis 1100 µm wurden in Hinblick auf mechanische Kennwerte wie E- Modul, (GPa), Bruchfestigkeit (MPa) und Porosität (%) unter axialer Kompression untersucht.
Ergebnisse
Der E- Modul für Reintitan betrug zwischen 1,2 und 2,8 GPa, für TiAl6V4 zwischen 2,3 und 8 GPa. Die Bruchfestigkeit für Reintitan und TiAl6V4 nahm Werte zwischen 20 und 100 MPa an, die Porosität lag zwischen 70 und 83%.
Diskussion
Die hochporöse Struktur von VITOFOAM™ mit seinen mechanischen Eigenschaften, kombiniert mit der hervorragenden Biokompatibilität der Werkstoffen Reintitan bzw. TiAl6V4 oder TiAl6V4 lassen VITOFOAM™ als sehr guten Knochenersatz erscheinen. Spongiöser Knochen weist eine Porengröße zwischen 300 und 1500 µm, einen E- Modul von 0;2 - 2 GPa, eine Bruchfestigkeit zwischen 5 und 50 MPa und eine Porosität von 30- 95% auf. Diese Werte konnten in der aktuellen Studie mit VITOFOAM™ erzielt werden.
Poröser Titanschaum stellt mit seinen osteokonduktiven Eigenschaften eine kostengünstige Alternative dar.
Implantatkosten für die interkorporelle Fusion in der Wirbelsäulenchirurgie können um bis 50% gesenkt werden. Derzeit werden Studien mit VITOFOAM™
durchgeführt, da dieser Werkstoff problemlos mit Tricalciumphosphat, Hydroxylapatit, Antibiotika oder Zytostatika beschichtet, aber auch mit Wirkstoffen zur kontinuierlichen Wirkstoffabgabe gefüllt werden kann.
Korrespondenzanschrift Dr.-Ing. Ulrich Holzwarth Med-Titan
Henkestraße 91 D-91052 Erlangen
C. Kliewe, K. Brökel, W. Mittelmeier, R. Bader
Kinematische Grundlagen und Konzeption eines Bewegungssimulators für Hüftendoprothesen
Kinematic basis and conception of a simulator for total hip endoprostheses
Einleitung
Zur Analyse der Subluxation und Luxation von Hüftendoprothesen ist die Kenntnis der natürlichen Bewegungen erforderlich und nachzubilden. Im natürlichen Gelenk werden Drehungen um das Rotationszentrum in beliebigen Richtungen ausgeführt.
Dabei werden die Drehungen in den Haupt- bewegungsrichtungen Beugung/ Streckung, Abduktion/
Adduktion sowie Innen-/ und Außenrotation beschrieben. Um die natürlichen Bewegungen auf einem technischen System abbilden zu können, sind Drehachsen in der Anordnung einer konkreten kinematischen Kette zu definieren.
Methode
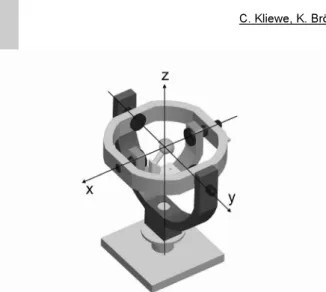
Die in der Medizin gebräuchlichen Methoden zur Erfassung der Gelenkstellung entsprechen der Drehfolge X-Y-Z nach Euler- Fall 1. Dabei wird zunächst der Femur in Richtung Flexion/Extension ausgelenkt und anschließend die Bewegungsfreiheit in den anderen Richtungen (Abduktion/Adduktion sowie Innen- und Außenrotation) ausgeführt. Es handelt sich hierbei um überlagerte Bewegungen um alle drei Achsen, wobei die Achsen Y und Z sukzessive gemäß der kinematischen Kette mitgedreht werden. Die kinematische Kette für das Ersatzmodell ist in Abbildung 1 dargestellt. Die X-Achse (Flexion/ Extension) ist dabei eine ortsfeste Achse.
Abbildung 1: Drehfolge X-Y-Z nach Euler Fall 1- Anatomisches Ersatzmodell
Entsprechend der definierten kinematischen Kette mit der Drehfolge X-Y-Z lauten die Rotationsmatrizen für die Einzeldrehungen:
»»
»
¼ º
««
«
¬ ª
=
a a
a a
x a
R
D D
D D
D
cos sin
0
sin cos
0
0 0 1 ) (
»»
»
¼ º
««
«
¬ ª
=
a a
a a
Ry
E E
E E
E
cos 0 sin
0 1 0
sin 0 cos ) (
»»
»
¼ º
««
«
¬
ª
=
1 0 0
0 cos sin
0 sin cos
)
( aa aa
Rz J J
J J
J
Die Gesamtrotationsmatrix für das anatomische Ersatzmodell ergibt sich wie folgt:
) (
* ) (
* )
( a y a z a
x
a R R R
R =
D E J
Die Multiplikation des in der Schaftachse des Femur liegenden Vektors in der Ausgangslage mit
R
a liefert die Stellung dieses Vektors in der verdrehten Lage:*
Fe0 aFe
R n
n =
Für eine technische Simulation bietet sich eine kardanische Lagerung des Femur an. Dabei werden die Bewegungen zu den drei Gliedern der kinematischen Kette so zugeordnet, dass zum einen ein größtmöglicher Bewegungsumfang realisiert werden kann und andererseits möglichst kleine Antriebsmomente für die mitbewegten Achsen X und Y notwendig sind. Dies wird erreicht durch die Kombination der Bewegung mit der größten Amplitude und somit den größten Beschleunigungen mit dem Glied der Kardanischen Lagerung, welches das geringste Massenträg- heitsmoment besitzt. Die Flexion/Extension wird deshalb auf dem inneren Ring der Kardanischen Lagerung ausgeführt. Die Abduktion/ Adduktion ist dem mittleren Ring, die Innen- und Außenrotation dem äußeren Ring zugeordnet (Abbildung 2). Diese Anordnung entspricht der Drehfolge nach Euler- Fall 2, nach dem eine Drehung um die ortsfeste Z-Achse die Verdrehung der Y- und der X-Achse zur Folge hat.
C. Kliewe, K. Brökel, W. Mittelmeier, R. Bader
Abbildung 2: Drehfolge Z-Y-X gemäß kinematischer Kette des Prüfstandes nach Eulerfall 2
Die kinematische Kette und damit auch die Drehfolge des anatomischen Ersatzmodells unterscheiden sich von der des Bewegungssimulators. Die Kardanwinkel des anatomischen Ersatzmodells sind auf den Simulator umzurechnen. Bei einer gegebenen Rotationsmatrix
R
ades anatomischen Ersatzmodells erhält man die Kardan- Winkel des Simulators durch Auslesen der Elemente aus dieser Matrix. Der Wert für
sin E
kist zu finden in der ersten Spalte, dritte Zeile in der MatrixR
a.sin E
k= R
a13k
k
R
aJ E
cos = cos
11k
k
R
aD E
cos = cos
33Ergebnisse
Mit dem beschriebenen Verfahren lassen sich beliebige Gelenkstellungen mittels des anatomischen Ersatzmodells beschreiben und auf dem Bewegungs- simulator umrechnen.
Darüber hinaus kann für gegebene Femurstellungen unter Vorgabe der Einbaulage der künstlichen Hüftpfanne (gemäß radiographischer Definition [5]) sowie den Abmessungen der Prothesenteile mit Hilfe des Skalarproduktes beider Vektoren diejenige Stellung berechnet werden, bei der aus einer beliebigen Gelenkstellung heraus durch weitere Bewegungen in den drei Achsen der kardanischen Lagerung der Schaft an die Gelenkpfanne anschlägt (Prothesen-Impingement).
Liegen zudem von den Knochenstrukturen in Form eines Computertomographie-Datensatzes vor, so kann mittels einer Abstandsberechnung von markanten Punkten des Femur zur Punktewolke des Beckens das Knochen- Impingement in die Untersuchungen mit einbezogen werden. Auf diese Weise können luxationsrelevante Situationen des künstlichen Hüftgelenks auf den Simulator abgebildet werden.
Diskussion
Mit dem konzipierten Bewegungssimulator kann die Luxationsstabilität von Hüftendoprothesen unter realitätsnahen Einbaubedingungen durch Einleiten von Kräften und Momenten simuliert werden, wenn die gelenkumschließenden Strukturen wie Kapsel, Sehnen und Bänder in ihrer Wirkung erfasst werden können.
Durch theoretische Untersuchungen (Mehr-Körper- Simulation ) ist die stützende Wirkung dieser Weichteile zu bestimmen. Für den Versuchsaufbau sind die künstlichen Muskeln, Sehnen und Bänder an den künstlichen Gelenken zu applizieren, um die theoretischen Aussagen abzusichern
Literatur
[1] Bergmann G, Graichen F, Rohlmann A. Hip joint loading during walking and running, measured in two patients. J Biomech 1993; 26: 969-990.
[2] Bader R et al., Vorrichtung zur Evaluierung der Luxationsstabilität von künstlichen Hüftgelenken;
Gebrauchsmuster DE 20200415, 2002,
[3] Bader R, Scholz R, Steinhauser E, Busch R, Mittelmeier W, Methode zur Evaluierung von Einflussfaktoren auf die Luxationsstabilität von künstlichen Hüftgelenken. Biomed Technik 49 (2004) 137-144.
[4] Ibrahim A. Kapandij, Funktionelle Anatomie der Gelenke, 3. Auflage
Ferdinand Enke Verlag, Stuttgart, 2001
[5] Murray D.W, Definition and measurement of acatabular orientation, J Bone Joint Surg Br. 1993, 75:
228-232.
Korrespondenzanschrift Dipl.-Ing. Christian Kliewe
Lehrstuhl für Konstruktionstechnik/ CAD Universität Rostock
Albert-Einstein-Straße 2 D-18059 Rostock
S. Kloth
Der Weg zu einem harmonisierten Marktzugang für Produkte zum Einsatz in der Regenerativen Medizin
Regenerative Medicine: The Harmonized Access to the European Market for Advanced Therapeutics
Introduction
Regenerative medicine is a multidisciplinary, young and emerging biotechnology sector, which promises to change medical practise profoundly. Whether cell or gene therapeutics or tissue engineered products are concerned, there is a lot of hope connected to this novel biotechnology developments with regard to improved treatment possibilities and enhanced quality of life of patients.
Products already on the market are available for the regeneration of skin, cartilage or bone defects. However, Europe-wide market authorization is presently hampered by the fact that no harmonized legislation exists.
The presentation will give an overview on the current requirements for market authorization including information on the draft regulation on advanced therapies.
Material and Methods
Information was gathered by analysing the relevant texts and publications (Refs. 1 and 2). In addition, the author attended the Hearing on Advanced Therapies held in Bruessels, May 2006.
Results and Discussion
The regulation on advanced therapies will be applicable for tissue engineering products as well as for gene and cell therapeutics. It details the requirements for market authorization, and specifies the responsibilities for surveillance and pharmacovigilance for this group of products.
With regard to the cell material used for the manufacture of advanced therapeutics two Directives are already in effect. Directives 2004/23/EC and 2006/17/EC detail requirements for donation, procurement, testing, handling and storage of human cells and tissues. These Directives is of importance for the sourcing of human cell material to be used in applications for regenerative medicine. The Directives do not apply for autologous cells to be used for the purposes of the donor, organs, blood cells or cells derived from animals.
The Directives provide definitions and outline requirements for the accreditation, designation and control of establishments involved in the sourcing and preparation of cells and tissues and gives advice for the relevant production processes involved. In the Annex it is specified that for the handling of cells and tissue preferably certified medical devices are to be used.
In addition requirements for the im- and export of cells and tissue are given, and the important issues of donor selection criteria and traceability of donors and recipients are addressed. The Directives came into effect in 2006 and are now to be implemented by all member states.
The relevance of the drafted regulation and the directives for the manufacture of tissue engineered products will be discussed.
Literature
[1] Directive 2004/23/EC of the European Parliament and of the Council of 31 March 2004 on setting standards of quality and safety for the donation, procurement, testing, processing, preservation, storage and distribution of human tissue and cells. Official Journal of the European Union (2004) L 102, p. 48-58.
[2] Directive 2006/17/EC of the European Parliament and of the Council of 8 February 2006 implementing Directive 2004/23/EC of the European Parliament and of the Council as regards certain technical requirements for the donation, procurement, and testing of human tissue and cells. Official Journal of the European Union (2006) L 38, p. 40-52.
Korrespondenzanschrift Prof. Dr. Sabine Kloth
TÜV SÜD Product Service GmbH Ridlerstr. 65
D-80339 München
D. Klüß, C. Zietz, T. Lindner, W. Mittelmeier, K.-P. Schmitz, R. Bader
3D-CAD-Untersuchung des Bewegungsumfanges von Kappenendoprothesen im Vergleich zu einer Standardhüftendoprothese
3D-CAD-Analysis of the Range of Motion of Hip Resurfacing Arthroplasty compared to a Standard Total Hip Arthroplasty
Einleitung
Der Oberflächenersatz arthrosegeschädigter Hüftgelenke mit einer Kappenendoprothese wird aufgrund neuer Metall-Metall Gleitpaarungen zunehmend angewendet.
Befürworter dieser Therapie betonen die knochen- schonende Behandlung des Femur und die gute Ausgangslage für Revisionen, welche mit einer herkömmlichen Totalendoprothese durchgeführt werden können. Da die Oberflächenersatz-Therapie vornehmlich bei jüngeren Patienten Anwendung findet, stellt sich die Frage, ob Kappenprothesen für aktivere Patienten genügend Bewegungsumfang bereithalten. Das aufgrund des relativ dicken Femurhalses ungünstige Verhältnis zwischen Hals- und Kopfdurchmesser lässt einen ungenügenden Bewegungsumfang vermuten. In der vorliegenden Studie werden mit 3D CAD-Modellen Bewegungssimulationen durchgeführt und die Bewe- gungsumfänge bis Impingement gemessen.
Material und Methode
Die Kappenendoprothesen wurden zunächst in folgenden Parametern geometrisch definiert: Kopfdurchmesser DKopf, Halsdurchmesser DHals in Abhängigkeit der Höhe des Halsübergangs a, Pfannenaußendurchmesser DPfanne und Kopfüberdeckung M. Die untersuchten Kappen- endoprothesen stellen sechs Variationen dieser Parameter dar (Tabelle 1).
Tabelle 1: Variation der geometrischen Parameter
Kopf Pfanne DKopf(mm) a (mm) DHals (mm) DPfanne(mm) M
1 42 8 34.5 48 180°
2 42 8 34.5 48 165°
3 48 10 39.2 54 180°
4 48 10 39.2 54 165°
5 56 12 43.8 62 180°
6 56 12 43.8 62 165°
Aus Computertomographie (CT)–Daten der Becken dreier Patienten mit entsprechenden Femurkopfdurchmessern wurden mit der Software AMIRA das Becken und das Femur dreidimensional am Rechner rekonstruiert. Die daraus erhaltenen Facettenmodelle wurden mit der Software GEOMAGIC in analytisch definierte Oberflächenmodelle umgewandelt, um die Simulation im 3D CAD-Programm (Pro/Engineer) zu vereinfachen. Die acetabuläre Komponente wurde mit ihrem eigenen Rotationszentrum in das anatomische Rotationszentrum des Hüftgelenks gelegt und entsprechend Inklination (45°
und 60°) und Anteversion (-15°,0°,15° und 30°) positioniert. Das Femur wurde entsprechend der verwendeten Kappenendoprothese reseziert und die Prothese in einem CCD-Winkel von 135° aufgesetzt. Mit dem implantierten Oberflächenersatz wurden bei fünf verschiedenen Implantatpositionen jeweils drei Bewegungsumfänge gemessen: 1. maximale Flexion, 2.
maximale Innenrotation bei 90° Flexion und 3. maximale
Außenrotation bei 15° Adduktion und 10° Extension. Die Bewegungen wurden simuliert bis ein Anschlagen des Femurhalses an die Pfanne bzw. ein Anschlagen des Femur an den Beckenknochen eintrat. Die Bewegungs umfänge der Kappenprothesen wurden mit einer Standardendoprothese mit 36 mm Kopf verglichen.
Ergebnisse
Bei allen Implantatpositionen zeigten die Kappenendo- prothesen gegenüber den Standardprothesen deutlich reduzierte Bewegungsumfänge. Bei Kappenprothesen mit 180° Kopfüberdeckung war der Bewegungsumfang im Durchschnitt um 47° geringer, bei reduzierter Kopfüber- deckung von 165° wurde eine Reduktion des Bewegungs- umfanges gegenüber der Standardprothese um durch- schnittlich 35° gemessen. Keine der untersuchten Kappen prothesen erlaubte eine maximale Flexion von 90°
(Tabelle 2). Eine Simulation der Innenrotation bei 90°
Flexion konnte bei 45° Inklination und 15° Anteversion sowie 60° Inklination und 30° Anteversion der Pfanne nur bei außenrotierter Ausgangsposition durchgeführt werden, bei allen anderen Implantatstellungen war diese Bewegung aufgrund des überschneidenden Prothesenhalses nicht möglich.
Tabelle 2: Bewegungsumfänge für maximale Flexion
Implantatdesign Pfannenposition (Inklination / Anteversion [°]) DKopf M 45/-15 45/0 45/+15 60/-15 60/+30 42 mm 180° 50° 64° 35° 30° 92°
42 mm 165° 63° 77° 47° 49° 107°
48 mm 180° 51° 65° 36° 31° 94°
48 mm 165° 64° 78° 49° 47° 107°
54 mm 180° 58° 71° 42° 39° 87°
54 mm 165° 62° 74° 45° 43° 102°
36 mm Standard 98° 110° 81° 91° 143°
Diskussion
Die Ergebnisse zeigen, dass durch das ungünstige Verhältnis von Prothesenhals und Kopfdurchmesser bei Kappenendoprothesen frühzeitig Impingement auftreten kann, v.a. bei flach gestellter Pfanne. Das Anschlagen des Halses am Pfannenrand kann für Schenkelhalsbrüche, Subluxationen und vollständige Luxationen verantwortlich sein. Design und Positionierung der Implantate müssen exakt geprüft werden, bevor ein Oberflächenersatz zur Versorgung arthrosegeschädigter Hüftgelenke junger Patienten eingesetzt wird.
Korrespondenzanschrift Dipl.-Ing. Daniel Klüß
Orthopädische Klinik und Poliklinik, Universität Rostock Doberaner Str. 142
D-18057 Rostock
A.Kolk, C. Haczek, C. Pautke, H. Deppe, T. Tischer, A. Stemberger, C. Plank
Copolymer protected BMP-2 gene vectors immobilized in poly (D,L-lactide) films on titanium implants mediate bone regeneration in a rat mandibular critical bone defect modelTitel
We have established titanium implants with PDLLA coatings comprising copolymer-protected gene vectors (COPROGs ; Finsinger et al. 2000, Gene Ther. 7:1183) for localized growth factor gene delivery and demonstrate their usefulness in mediating bone regeneration in a critical bone defect model. Lyophilized vectors were resuspended in PDLLA solutions in organic solvent and applied to disks of 20 m titanium foils followed by drying on air. Vector release was characterized using I-125 labeled plasmid DNA.
Luciferase and BMP-2 gene delivery to cells grown on the implants was examined. Cell viability was characterized with an MTT assay. Critical size defects were set in the mandibular angle of Sprague Dawley rats.
The defects were covered with titanium foils coated at different concentrations with PDLLA comprising either BMP-2 COPROGs , or recombinant human BMP-2 or protective copolymer alone, respectively. Qualitative and quantitative analysis of newly formed bone was performed by CT, spectral imaging, histology and histometry.
In vitro, vectors were released in an initial burst (15 - 25
% of applied dose) within the first day, followed by a phase of sustained release over the next 4 weeks (1 – 2
% per day). COPROGs release increased with an increasing vector-to-PDLLA ratio. At high released doses, cell viability was low. Gene transfer efficiencies in vitro displayed distinct optima depending on the cell line, vector dose and vector-to-PDLLA ratio and correlated with cell viability. Luciferase and BMP-2 gene expression in NIH 3T3 and 293 cells remained detectable (luminometry, ELISA) for at least one weak after reaching peak expression within 48 hours. In contrast, BMP-2 expression in mesenchymal stem cells became detectable only by day 3, reaching peak levels by day 6.
In the in vivo model, BMP-2 COPROGs -comprising PDLLA coated titanium implants gave rise to partial bridging of the bone defects within 14 days and complete bridging within 56 days when the DNA dose per implant did not exceed 25 g. Higher doses led to none-bridging and seroma, possibly due to toxic side effects. Implants coated with recombinant human BMP- 2 in PDLLA resulted in a fast defect bridging with a thin, lace-like bone in the defect and a huge amount of heterotopic bone outside the defect. The volume of this undesired bone decreased until the 112th day, putatively because of insufficient vascularisation. BMP-2 COPROGs induced bone displayed more coarse trabeculae compared with recombinant human BMP-2 induced bone. No bone bridging was observed in untreated control defects or those treated with implants coated with copolymer alone in PDLLA.
In conclusion, the delivery of plasmid DNA coding for BMP-2 formulated as COPROG in a biodegradable PDLLA matrix appears to be a potent method for controlled new bone formation.
Korrespondenzanschrift
Department of Oral and Maxillofacial Surgery Technische Universität München,
Ismaninger Strasse 22, D-81675 Munich