AUS DEM LEHRSTUHL FÜR PATHOLOGIE PROF. DR. MATTHIAS EVERT
Volltext
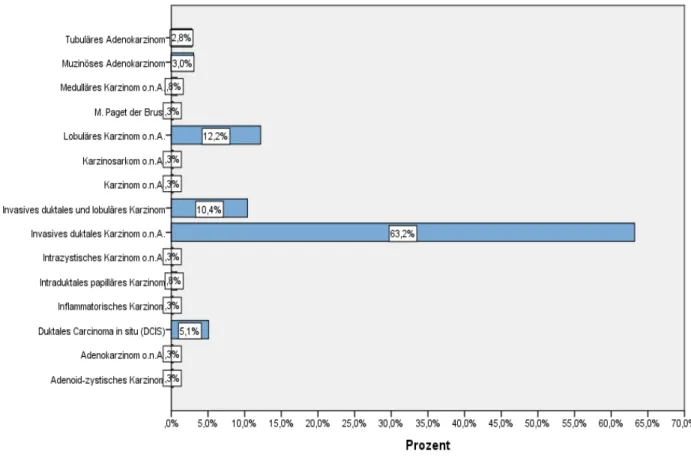
Abbildung
ÄHNLICHE DOKUMENTE
Bond et al begründetet dies damit, dass beim B-Zell-Lymphom der Östrogenrezeptor (ER) exprimiert wird und dieser einen Einfluss auf SNP309 nimmt: sollte dies der Fall sein,
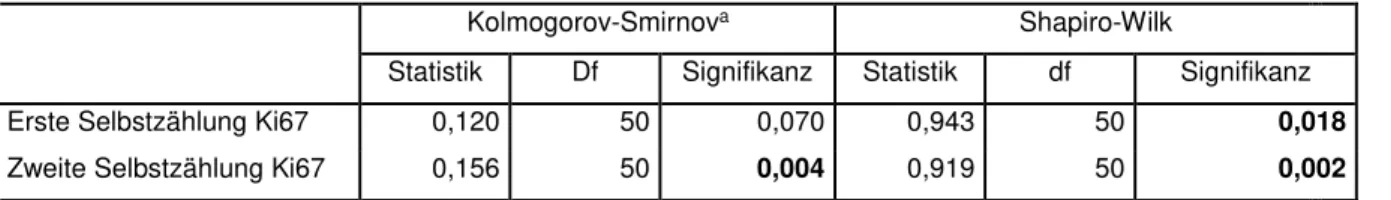
Denn insgesamt fand sich in der hier vorliegenden Arbeit nur bei 38,5% der Fälle mit positivem Chromosom 7/EGFR-Befund in der FISH (Trisomie, höhere Polysomie,
Eine Studie hat ergeben, dass die Expression aller vier ErbB-Rezeptoren mit verkürztem Überleben asso- ziiert sein soll und dass der prognostische Wert noch ansteigt, wenn man
In dieser Arbeit konnte kein Zusammenhang zwischen dem SNP309 im MDM2-Gen und einer erhöhten Anfälligkeit eines bestimmten Geschlechts für das NZK hergestellt
charakteristisch für hellzellige Nierenzellkarzinome ist, so würde sich im Hinblick auf die Differenzierung vom chromophoben Nierenzellkarzinom eine Sensitivität von 93,7 % bei
a) gegenüber einem nachrangigen geschiedenen Ehegatten b) gegenüber nicht privilegierten volljährigen Kindern c) gegenüber Eltern des Unterhaltspflichtigen.. 2.
Abschläge für Stickstoffnachlieferung aus der Stickstoffbindung von Leguminosen bei Grünland und mehrschnittigem Feldfutter. Quelle: Anlage 4 Tabelle 12
Für Gemüsekulturen sowie Dill, Petersilie und Schnittlauch mit einer Folgekultur der Tabelle 11 im gleichen Jahr gelten die Werte nach Tabelle