AS,
^ cr-vs«^
BERUFSVERBAND
DEUTSCHER LABORÄRZTE e.V.
Physicians 7 Office Laboratories in the United States:
Evolution and Regulation
Laboratorien von niedergelassenen Ärzten in den Vereinigten Staaten:
Entwicklung und Gesetzgebung
Mario Werner, M. D., Carol J. Pauley
Clinical Chemistry Laboratory, The George Washington University Medical Center, 901 Twenty-third Street, N. W., Washington, D. C. 20037
Summary:
We first analyze the current forces favoring the dispersal of analytical activity. Both maturing technology and the nature of the demand appear to favor the establishment of physicians' office laboratories. However, the essential issue is not whether laboratory services can be decentralized, but whether they should. The suc- cessful operation of any laboartory demands a multifaceted integration of expertise and meaningful labora- tory regulation must meld technical, managerial and medical considerations.
Second, we trace the evolution of legislation applicable to physicians' office laboratories. The Clinical Labora- tory Improvement Amendments of 1988 (CLIA '88) mandated a single set of rules under federal oversight for all laboratories including those of physicians not previously regulated. Three options are established depen- ding on the complexity of service, but the regulatory details for this classification have, not been finalized.
However, the framework of the new law integrates technical, managerial and medical concerns, and this may have some lasting value.
Last, we assess relevant developments in the marketplace of laboratory services. The two mutually consistent conclusions are: On the one hand, current technology for physicians' office laboratories does not meet the precision achievable in larger laboratories and in some instances may not meet the medically required preci- sion. On the oifier hand, American physicians continue to rely more on reference laboratories than their own analytical capability as test volume increases.
Introduction
In the diagnostic system which saw humoral dyscrasias . as the cause of disease, inspection of body fluids for cen-
turies had pivotal significance. Usually, the attending physician performed these examinations while seeing the patient and in some European countries, this tradi- tion prompted physicians to continue performing their own analyses as scientific methods became available. I n . contrast, physicians in the United States in the past have not generally performed laboratory analyses in their offi- i ces, but recently this practice is changing. Indeed, profes- ' sional organizations of laboratory scientists and clinical
pathologists have proposed that consultation to physi-
cians in private practice who operate office laboratories become a profitable new frontier for the activity of their members. Consequently, we first analyze the current for- ces favoring the dispersal of analytical capability, next we trace the evolution of legislation applicable to physicians' office laboratories in the United States, and last we as- sess pertinent developments in the marketplace of health care.
Forces shaping the dispersal of analytical capabilities
The demand for laboratory tests has increased annually over more than three decades. At the same time, techno- Lab.med. 14, Nr. 12: BDL 131 (1990) BDL 131
logical advances have continually improved laboratory productivity. In the Chemistry Laboratory of The George Washington University Medical Center, for instance, de- mand for blood analyses expanded about 70% over one decade. Simultaneously, the College of American Patho- logists' Workload Recording Method (1) decreased the to- tal "credit" allowed for this increased clinical chemistry testing by about 30%. Accordingly, laboratory producti- vity had to increase about 250%. Both the astounding gains of clinical demand for biochemical information, and of the facility of supplying it pose the questions, whether rendering analytical capability more accessible by dispersing it would be technologically feasible and would satisfy still unmet needs.
Evolution of technology
Modern Clinical Chemistry originally relied exclusively on manual procedures. Such labor intensive technology was not only expensive, but resisted economies of scale as the workload grew, since each assay required similar effort regardless of the size of the analytical run. Favoring neither centralization nor dispersal of analytical capabi- lity, manual technology was "site neutral·'. The emer- gence of continuous flow analysis about 1960 markedly reduced the cost for incremental tests, but high set-up costs rendered short analytical series uneconomical.
Such technology favored centralizing analytical capability in referral laboratories, where large analytical runs can be assembled. Over the last two decades, random access analyzers and other technical advances reduced the cost per incremental test for ever shorter analytical runs, and today, individual tests frequently can be processed at equally low cost as tests in a series of any length. Such technology favors dispersal of analytical capability as it is similarly economical in settings with widely dissimilar workloads. Thus, modern procedures have the potential to make physicians' offices, where workloads typically are small, cost competitive.
Analytical needs in physicians' offices
The clinical setting determines the demand for clinical laboratory information in predictable fashion (2). At the George Washington University Medical Center, for instance, the ten most frequent individual test requests accounted for about 40% of blood chemistries ordered in hospitali- zed patients. This list included a 12-test and a 6-test pro- file, glucose, electrolyte, creatinine and bilirubin assays.
At the same time, the ten most frequent requests accoun- ted for about 60% of blood chemistries ordered in emer- gency room patients. This menu included blood gases, amylase and alcohol assays, but not bilirubin and creati- nine assays as in hospitalized patients. Finally, the ten most frequent individual requests surprisingly accounted for 70% of blood chemistries ordered in clinic outpa- tients, which presumably duplicate the ambulatory pa- tient population seen in physicians' offices. This latter list included cholesterol, triglyceride and thyroxine assays, but not the tests characteristic for the emergency popula- tion, and only creatinine but not bilirubin assay as for hospitalized patients. This remarkable concentration of demand on few types of chemical analyses can be ac- commodated with relatively simple and inexpensive in- strumentation favoring dispersal of analytical capabili- ties. Both the maturing technology and the nature of me- dical demand thus appear to facilitate the establishment of physicians' office laboratories. However, the essential issue is not whether laboratory services can be decentra- lized, but whether they should.
Obstacles to the dispersal of analytical capability into physicians' offices
By themselves, analytical findings cannot resolve clinical problems. A crucial chain of professional decisions sepa- rates the availability of an analytical result from the ne- cessary medical action (3). Appropriate patient manage- ment requires that the following sequence of alternatives be resolved: is the result normal or abnormal? Is the ab- normal finding recognized or is it ignored? Is a recogni- zed abnormal result previously known or not known? Is the test reordered or not reordered to verify an abnormal result? If the patient is retested, is the result normal or abnormal? Is the patient treated or not treated? Any mis- sed or erroneous decision in this sequence can render the outcome for the patient as unfavorable as had he ne- ver been tested, or had the test produced a misleading finding.
Equally complex considerations determine reliability in the purely technical domain, where choice of method, in- strumentation and quality control can each affect out- come, as well as in the managerial domain, where per- sonnel policies, follow-up of incidents, and information management equally influence outcome. Consequently, the successful operation of any laboratory demands a multifaceted integration of expertise, and meaningful re- gulation of physicians' office laboratories should meld technical, managerial and medical considerations (Table 1).
Evolution of legislation
The United States Congress periodically reviews the fun- damental legislation governing clinical laboratories. The most recent Clinical Laboratory Improvement Amend- ments of 1988 (CLIA '88) (4) not only legislate stricter fed- eral oversight, but mandate a single set of rules for all la- boratories, including those who had not been regulated by the preceding Clinical Laboratory Improvement Act of 1967. Under that earlier legislation, office laboratories which exclusively performed tests on a physician's own patients and which accepted no referrals whatsoever, were exempt from the federal regulations placed on oth- er clinical laboratories. Based on the type of tests perfor- med, CLIA '88 now requires all laboratories either to be certified or to be specifically exempted through a certifi-
Table 1: Technical, managerial and medical issues for considera- tion in the regulation of physicians' office laboratories Technical
Test Performance Result Reporting Quality Control Quality Assurance Safety
Infection Control Managerial
Technical Proficiency and Education of Personnel Information Management
Productivity
Follow up of Incident Reports Evaluation of User Satisfaction Evaluation of Survey Results Medical
Clinical· Appropriateness of Test Orders ^ Clinical Appropriateness of Medical Decisions
Based on Test Results 132 BDL Lab.med. 14, Nr. 12: BDL 132 (1990)
cate of waiver. This change places an unprecedented number of medical laboratories under federal regulation, and directly affects many physicians as the law now cov- ers every site where human specimens are analyzed.
Some estimate that over half a million laboratories will be affected.
The same Act of Congress charges the Department of Health and Human Services (HHS) to develop uniform re- gulatory standards for laboratories based on test comple- xity, and risk factors related to erroneous results thus not only widening the regulatory mission of the agency, but instructing it to redesign its regulatory methods. Since more stringent state regulations may supersede these fe- deral regulations, some states, such as Pennsylvania and Illinois (5), have promulgated their own. Other states, such as Maryland and the District of Columbia (6), have regulations under consideration. The aggregate effect of so widening the scope of laboratory quality improvement has been to create new categories of bureaucratic pro- cess.
As vast numbers of laboratories that had never before been regulated would be affected, CLIA' 88 promptly evo- ked a flurry of professional and commercial reactions while regulations were being developed by the Health Care Financing Administration (HCFA), the responsible arm of the Department of Health and Human Services. In this period, the National Committee for Clinical Labora- tory Standards (NCCLS) produced a 237 page manual en- titled Physician's Office Laboratory Guidelines (7), which addresses the following subjects in some depth: labora- tory management; method/instrument selection, evalua- tion and operation; quality assurance; sample collection and transport; dry reagent tests. This comprehensive text offers useful information to owners of physician's office laboratories as well as to their consultants, but has not clearly influenced the official rules subsequently promul- gated by HCFA. The latter were published following a two-year delay in the March 14, 1990, Federal Register (8), allowing a two month comment period before final ac- ceptance. These rules now establish three categories of laboratories, Waivered, Level I and Level II Laboratories, but the regulatory details required for a final draft may not be set for some time, since over 3000 comments from the public were received. A new full text of propo- sed regulations and ancillary information was published in the May 21, 1990, Federal Register (9), setting another deadline of August 20, 1990, for further comments.
Waivered Laboratory
Such a laboratory can only perform "simple and low risk" tests with the following features: (1) there is no rea- sonable risk of harm to the patient if the test should be performed incorrectly (2), the likelihood of erroneous re- sults is negligible thus demanding only minimal interpre- tation (3), the testing method is simple requiring minimal or no patient and sample preparation, as well as minimal training and experience of the analyst, and (4) as the "fi- nal" criterion, identical methodology is available for home use. Regulation specifies the list of such waivered tests.
The rules for a Waivered Laboratory require a director be responsible for the quality of the services. The physician himself or another qualified professional may assume this role. The director retains maximum flexibility to em- ploy the personnel required to operate the laboratory. No personnel standards except for the director exist. The re- gulators appreciated that imposition of personnel stan-
dards would be futile, if the job market could not supply qualified applicants for a greatly increased demand. No federal requirement for proficiency testing, quality con- trol or quality assurance exist either, but a waivered labo- ratory may be subject to "random" inspection to verify that only waivered tests are performed or to investigate complaints.
Level I Laboratory
Tests performed in this laboratory are characterized as follows: (1) there may be a reasonable risk of harm to the patient, (2) the risk of erroneous results is present, but is minimized by the method, (3) test performance involves some independent judgement, (4) interpretation of test results, requires knowledge of a limited number of fac- tors which can influence results and (5) some training is required prior to test .performance. Regulation specifies the list of Level I tests.
The rules for a Level I Laboratory require a qualified direc- tor, general and technical supervisors. The physician him- self again may assume these roles. The director must function as the general supervisor and must be accessi- ble to the technical staff during regular hours of testing.
If he is unable to meet this obligation, he must delegate the responsibility to another individual who meets all the necessary requirements of a laboratory director. The di- rector must ensure that technical personnel have the ne- cessary training, experience and continuing education, that they receive continuous monitoring and evaluation of performance, and that they meet any applicable state licensure requirements. Regulation further mandates biennial inspection for compliance with the law, quality control/quality assurance standards/and personnel stan- dards, as well as quarterly proficiency testing for each analyte tested.
Level II Laboratory
The "complex and high risk" tests performed in this labo- ratory are characterized as follows: (1) there may be sub- stantial risk of harm to the patient, (2) the risk of errone- ous results is substantial, (3) test performance involves independent judgement and comprehensive understan- ding of the method (4) interpretation of test results requi- res knowledge of the many factors which can influence results, and (5) training is required prior to test perfor- mance. A Level II laboratory in essence may perform any test.
The regulatory requirements of a Level II Laboratory in- clude all of those for a Level I Laboratory. The director may again function as the required general supervisor. In addition, there must be a qualified technical supervisor for each speciality or subspeciality in which the Level II Laboratory performs testing. This person must spend an adequate amount of time in the laboratory to supervise the operations and must be readily available for consulta- tion. Personnel standards for education and experience exist for directors, technical supervisors, technologists, cytotechnologists and technicians. Clearly, these regula- tions are onerous enough to restrict the use of the Level II classification in physician' offices.
The performed tests determine the classification of an of- fice laboratory. At present, a Waivered Laboratory may perform such tests as urine dipsticks, fecal occult blood, urine pregnancy tests, slide card agglutination tests and other similarly simple assays. A Level I Laboratory in ad- dition may perform assays of microhematocrit and he- moglobin, white blood cell counts, urine sediment ex- Lab.med 14, Nr. 12: BDL 133(1990) BDL 133
aminations, and chemistries limited to urea, creatinine, glucose, uric acid and cholesterol assays. Performance of one or more tests not appearing on either the Waivered or the Level I list of tests implies classification at Level II.
The classifications of tests reflect the current state of technology. Technical progress as well as. new scientific documentation will without doubt change them.
Unavoidably, the specific assignments of procedures furt- her represent subjective judgements of the experts con- sulted, and negotiation as well as compromise influen- ced their choises. In particular, the issue of who should be granted a waiver from oversight remains controver- sial, and will take time to resolve, as the regulators found that no hard data were available on the "complexity of te- sting criteria".
On the other hand, the framework of the law has integra- ted the technical, managerial and medical concerns outli- ned above, and in this may have some lasting value.
However, rules written to encompass a vast scope of acti- vities such as CLIA '88 not only tend to become cumber- some but risk being counterproductive. In addition, im- portant practical questions remain unanswered, such as where the regulatory agency will find the many trained professionals required to administer the mandated profi- ciency testing.
Developments in the marketplace
Does Current Technology Meet Clinical Needs?
Despite the facts that much of todays laboratory equip- ment is presented as "black box" technology, and that
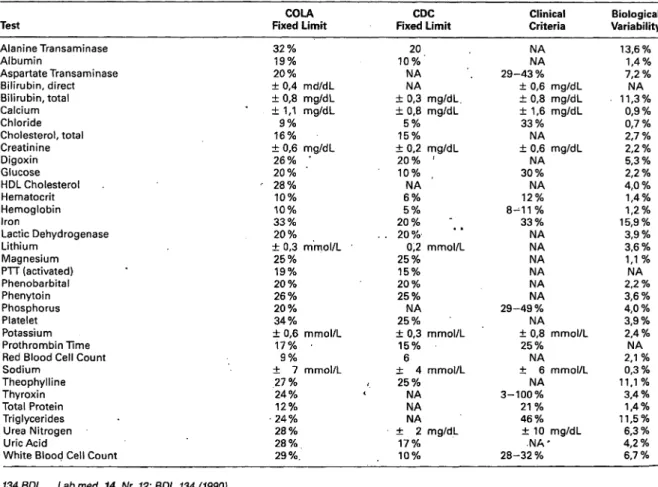
prepackaged reagent systems appear to leave little room for operator error, considerable analytical variability re- mains. Therefore, various medical societies, such as the American Society of Internal Medicine, the American Academy of Family Physicians and the College of Ameri- can Pathologists, have jointly constituted a Commission of Office Laboratory Assessment (COLA) to assess the re- producibility of relevant tests. Reflecting what today's technology presumably can do, this group has estab- lished grading criteria for some 34 assays (Table 2).
The proposed thresholds are up to two-fold larger than the imprecision limits proposed the Communicable Dis- ease Centers (CDS), and in most cases hospital laborato- ries would not accept the variability tolerated by the Commission. On the other hand, the Commission's limits are usually smaller than the allowable imprecision estab- lished in a study of "clinical utility" (10). In this, and a few other analyses, clinical case vignettes involving a la- boratory value were presented to a panel of practitioners, who were then asked what change in value would induce them to alter management of the case. While this anec- dotal approach may be meaningful in the specific con- text, it fails to capture the multiple uses to which labora- tory information is put clinically, some of which have more exacting demands for precision. Indeed, if analyti- cal imprecision should be equal or less than one half the average intra individual biological variation, much nar- rower tolerance limits would result (11).
How rapidly are office laboratories set up?
Table 3 compares annual growth rates for eight labora- tory sections, calculated from charges approved from Table 2: Comparison of grading criteria for analytical variability for.proficiency assessment Fixed limits for acceptable variability of the Commission Laboratory Assessment (COLA), and of the Communicable Disease Center (CDC) are compared to limits proposed for clinical utility (Reference 9) as well as limits based on biological variability (Reference 11)
Test
Alanine Transaminase Albumin
Aspartate Transaminase Bilirubin, direct Bilirubin, total Calcium Chloride Cholesterol, total Creatinine Digoxin Glucose HDL Cholesterol Hematocrit Hemoglobin IronLactic Dehydrogenase Lithium
Magnesium PTT (activated) Phenobarbital Phenytoin Phosphorus Platelet Potassium Prothrombin Time Red Blood Cell Count Sodium
Theophylline Thyroxin Total Protein Triglycerides Urea Nitrogen Uric Acid
White Blood Cell Count
Fixed LimitCOLA
32%
19%20%
± 0,4 md/dL
± 0,8 mg/dL
* ±1,1 mg/dL 16%9%
± 0,6 mg/dL 26% ' 20% '
• 28%
10%10%
33%
± 0,3 mmol/L20%
25%19%
20%26%
20%34%
± 0,6 mmol/L 17% ·
± 7 mmol/L9 % 27 %24%
12%24%
28%28%
29%.
Fixed LimitCDC
20 10%NA
± 0,3 mg/dL.NA
± 0,8 mg/dL 15%5%
± 0,2 mg/dL 20 % ' 10%
6%NA 20 %5%
. 20%
0,2 mmol/L 25%15%
20%25%
25%NA
± 0,3 mmol/L 15%6
± 4 mmol/L 25%NA
NANA
± 2 mg/dL 17%10%
Clinical Criteria NANA 29-43%
± 0,6 mg/dL
± 0,8 mg/dL
± 1,6 mg/dL 33%NA
± 0,6 mg/dL 30%NA 12%NA 8-^11%
33%
NANA NA NANA 29-49%NA
± 0,8 mmol/LNA 25%NA
± 6 mmol/L 3-100%NA
21%46%
± 10 mg/dL 28-32%.NA'
Biological Variability 13,6%
7,2 %1,4%
11,3%NA 0,9 % 0,7 % 2,7 % 5,3 %2,2%
2,2 % 4,0 % 1,4%1,2%
15,9%
3,9 % 3,6%1,1 % 2,2 %NA 3,6%4,0%
3,9%2,4 % 2,1 %NA 0,3 % 11,1%
3,4 % 11,5%1,4%
6,3%4,2%
6,7 % 134 BDL Lab.med. 14, Nr. 12: BDL 134 (1990)
Table 3: Annual Growth rates by test category for independent laboratories and for physicians' office laboratories. Data were calculated from charges approved from 1985 to 1987 under Me- dicare Part B for non-hospital providers
Test Category
Independent Physicians' Laboratories, Office Labor-
% ,atories, % Both, % Automated _
Chemistry & toxicology Hematology
Immunology Microbiology Organ or disease
panels Therapeutic drug
monitoring Urinalysis
3319 29 3025
* 42 3923
5 109 1710
188 21
14 2417 27 18 58 304
All tests 28 10 19
1985 to 1987 under Medicare Part B for non-hospital pro- viders. During that period, test volume increased bet- ween about 20% and 40% in different sections of inde- pendent laboratories (28% overall average increase). Test volume simultaneously increased less than 20% in all la- boratory sections of physicians' offices except for the sec- tion organ or disease panels (10% overall average in- crease).
Together the described developments in the marketplace of laboratory services suggest two mutually consistent conclusions. First, current technology for physicians' of- fice laboratories does not meet the precision achievable in larger laboratories and may not meet the medically re- quired precision in some instances. Second, American physicians continue to rely more on reference laborato- ries than on their own analytical capability as test vo- lume increases.
Störungsfreie HPLC
mit stets gleichbleibend hoher Reinheit
SSS:Ä=E:
Die hohe, garantierte Reinheit und das zusätzliche Analysen-Zertifikat auf jedem Flaschenetikett sind ein doppelter Qualitätsbeweis. Darauf ist Verlaß.
Sie können deshalb mit „Baker Analyzed" HPLC-Lösemitteln ganz sicher sein, daß Ihr Analysenergebnis aus der Probe und nicht aus dem Reagenz stammt.
Mehr Informationen von Baker-Chemikalien Postfach 1661 · 6080 Groß-Gerau
References:
1. CAP Committee for Workload Recording: Manual for Laboratory Workload Recor- ding Method. College of American Pathologists, Northfield. IL (1989)..
2. WERNER, M.: Economics of microassays in the clinical laboratory. In: Microtechni- ques for the Clinical Laboratory, Concepts and Applications (Ed. M. Werner). John Wi- ley, New York, NY, 405-416 (1976).
3. ALTSHULER, C. H., WERNER, M.: How can appropriate transfer of laboratory infor- mation be assured. In: Quality Assurance in Health care: A Critical Appraisal of Clini- cal Chemistry. (Ed. R. N. Rand, R. J. Eilers, N. S. Lawson, A. Broughton). American As- sociation for Clinical Chemistry and College of American Pathologists, Washington- Chicago, 359-369 (1980).
4. Public Law 100-578, 100th Congress-, H. R. 5471, Clinical Laboratory Improvement Amendments of 1988, pages 8251-8263.
5. Illinois Clinical Laboratory Act of 1987, Illinois Revised Statute 1987, Chapter 111 1/2, Paragraph 621 et seq., as amended P. A. 85-1025 effective June 30, 1988, P. A.
85V1202, effective August 25,1988 and P. A. 85-1251, effective August 30,1988.
6. Clinical Laboratory Act of 1988, District of Columbia Act 7-240, Council of the Di- strict of Columbia, October 13, 1988.
7. Task Force on Decentralized Laboratories: Physician's Office Laboratory Guidelines (Proposed Guidelines). NCCLS Document POL1-P, Vol. 8, No. 1. National Committee for Clinical Laboratory Standards, Villanova, PA, (1988).
8. Medicare, Medicaid and CLIA Programs; Revision of Laboratory Regulations; Final Rule with Request for Comments. March 14/1990. 42 CFR Parts 74, 405, 416, 440, 482, 483. 488 and 493. Federal Register, 55 (50), 9538-9610 (1990).
9. Medicare, Medicaid and CLIA Programs; Regulations Implementing the Clinical Laboratory Improvement Amendments of 1988 (CLIA '88). Proposed Rule. May 21, 1990. 42 CFR Parts 405, 416. 440, 482, 483. 488 and 493. Federal Register, 55 (98), 20896-20959 (1990).
10. SKENDZEL. L P.. BARNETT, R. N., and PLATT, R.: Medically useful criteria for analy- tic performance of laboratory tests. Am. J. Clin. Pathol. 83 200-205, (1985).
11. FRÄSER, C. G.: The application of theoretical goals based on biological variation data in proficiency testing. Arch. Pathol. Lab. Med. 112,400-415, (1988).
Address correspondence to Prof. Dr. med. M. Werner Division of Laboratory Medicine The George Washington University Medical Center
23rd Street N. W.
USA-Washington, D. C. 20008
KRANKENHAUS THALW1L
Schätzen Sie als ausgebildete -
medizinisch-technische Laborantin
eine angenehme Arbeitsatmosphäre in einem fortschrittlichen Spital- betrieb mit familiärem Charakter?
Nach Übereinkunft suchen wir in unser kleineres Team eine kollegiale Mitarbeiterin mit Kenntnissen in Hämatologie, Serologie und klini- scher Chemie, sie sich auch anteilmäßig am Nacht- undWochenend- Pikettdienst beteiligt.
Neben einem selbständigen Verantwortungsbereich und zeitgemä- ßen Anstellungsbedingungen bieten wir Ihnen günstige Wohn- und Verpflegungsmöglichkeiten.
Ihre Bewerbung mit den üblichen Unterlagen richten Sie bitte an das:
Krankenhaus ThalWÜ, Personalsekretariat Tischenloostraße 55, CH-8800Thalwil (am Zürichsee) Telefon (00 41) 1-7 23 71 71
Lab.med. 14, Nr. 12: BDL 135 (1990) BDL 135
Aus der Geschichte der Labormedizin
Im 19. und der ersten Hälfte des 20. Jahrhunderts wurde die Labormedizin überwiegend in staatlichen Instituten, Medizl·
naluntersuchungsämtern und von Kreisärzten betrieben, meist in engem Verbund mit der Umweltmedizin, der damaligen Hygiene.
2. Die preußischen Medizinaluntersuchungsämter.
Von
Dr. Doepner,
Hilfsnihcitu im Ministerium des Innern.
Schon seit längerer Zeit hatte sich das Bedürfnis geltend ge- macht, die Fortschritte der Bakterienkunde mehr als bisher für die Erkennung und Bekämpfung der übertragbaren Krankheiten nutzbar zu machen. Als dann das Gesetz vom 16. September 1899, betreffend die Dienststellung des Kreisarztes und die Bildung von Gesundheitskommissionen, die Aufgabe der Kreisärzte er- weiterte und ihnen die Verpflichtung zur Ausführung einfacher physikalischer, chemischer, mikroskopischer und bakteriologischer Untersuchungen auferlegte, wurden durch den Staatshaushalt- etat für 1901 und für 1902 Mittel zur Ausstattung der Kreisärzte mit mikroskopischen und bakteriologischen Geräten zur Ver- fügung gestellt. Der Plan, auf diese Weise eine große Anzahl von kleinen, schnell erreichbaren Untersuchungsstellen einzurichten, erwies sich jedoch bald als undurchführbar, da die meisten Kreis- ärzte durch ihre anderweitige amtliche Tätigkeit, insbesondere durch die Dienstreisen, an der Durchführung bakteriologischer Untersuchungen gehindert wurden. So schritt man denn zur Ein- richtung einer Anzahl größerer Untersuchungsstellen bei den Regierungen. Diese Untersuchungsstellen wurden von Kreisassistenzärzten im Nebenamt versehen; sie bewährten sich ausgezeichnet, ihr Tätigkeitsbereich dehnte sich mehr und mehr aus und ihre Einrichtungen wurden nach und nach vermehrt und vervollkommnet. Im Jahre 1907 erhielten 10 dieser Labo- ratorien die Bezeichnung ,, Königliches Medizinahmtersuchungs- amt"; als Vorstand wurde je ein voll besoldeter Kreisarzt ange- stellt, dem in der Hälfte der Anstalten ein Kreisassistenzarzt als Assistent beigegeben wurde; solche Anstalten wurden in Gum- binnen, Potsdam, Stettin, Liegnitz, Magdeburg, Hannover, Stade, Münster, Coblenz und Düsseldorf errichtet. Daneben bestanden bei 7 Regierungen weniger vollkommen ausgestattete „Medizinal- untersuchungsstellen" unter Leitung eines Kreisassistenzarztes fort, und zwar in Marienwerder, Bromberg, Breslau, Osnabrück, Wiesbaden, Trier und Sigmaringen. Jeder der 17 Untersuchungs- anstalten wurden ein oder mehrere Regierungsbezirke als Arbeits- gebiet zuerteilt. Für den Rest des Staates wurden an 9 hygi- enischen Universitätsinstituten bakteriologische Untersuchungs- anstalten eingerichtet; ferner führten für einzelne Regierungs- bezirke selbständige staatliche Institute — das Institut für In- fektionskrankheiten in Berlin, das Institut für experimentelle·
Therapie in Frankfurt a. M. und die hygienischen Institute in Posen und Beuthen — , städtische Untersuchungsämter — in Breslau, Charlottenburg und Coin — und das Institut für Hygiene und Bakteriologie in Gelsenkirchen Untersuchungen aus.
Die Inanspruchnahme der Untersuchungsanstalten wuchs von Jahr zu Jahr, zumal die Mehrzahl der Kreise von der Vergünstigung, an Stelle der Einzelgebühren eine jährliche Bauschsumme für die Untersuchungen zahlen zu können, Gebrauch machten. Da das Personal der Anstalten die Arbeitslast nicht mehr bewältigen konnte, wurde am x. April 1910 eine Neuregelung vorgenommen, indem unter Einziehung einiger Untersuchungsstellen überall Untersuchungsämter mit einem Kreisarzt als Vorstand und einem Kreisassistenzarzt als Assistenten eingerichtet wurden; nur die Untersuchungsstellen in Bromberg und Sigmaringen blieben be- stehen.
1883 fand in Berlin und 1911 in Dresden eine große Hygiene- Ausstellung statt, auf denen sich die Medizinaluntersuchungs- ämter und Institute des Reichsgebietes präsentierten. Dies waren unter anderen:
Das Institut für medizinische Chemie und Hygiene der Universität Göttingen unter Prof. v. Esmarch:
Der Unterricht bestand aus einem dreistündigen Kurs in Bakteriologie und Hygiene und einem dreistündigen Kolleg in Hygiene für Mediziner. Außerdem wurde ein sechstägiger hygienischer Kurs für Direktoren und Oberlehrer höherer Lehranstalten eingerichtet, welcher sich "sehr bewährt hat".
Dem Institut war ein Medizinäluntersuchungsamt angeglie- dert, das im Eröffnungsjahr 1905 1621 Proben und im Jahr 1909 6854 Proben untersucht hat.
Das Physiologische Institut der Universität Münster wurde 1904 gegründet und verfügte über einen "großen Laborato- riumssaal mit 74 Arbeitsplätzen für die Abhaltung des physio- logisch-chemischen Kurses und des physiologischen Prakti- kums", über ein "optisches Zimmer mit dem Spektralapparat"
und über eine Zentrifuge, die "von einem Elektromotor von 21/2 Pferdestärken getrieben" wird und "5000 Umdrehungen in der Minute" "macht".
Das Institut für Hygiene und experimentelle Therapie in Marburg unter dem Wirkl. Geh. Rat Prof. Dr. E. v. Behring untersuchte 1907 knapp 1000 und im Jahre 1909 2791 Proben.
I n d e m U n t e r s u c h u n g s a m t f ü r a n s t e c k e n d e K r a n k h e i t e n hat sich die Zahl der eingesandten Proben von nicht ganz 1000 im Etatsjahre 1907 auf 2791 im Etatsjahre 1909 gesteigert. Sie wird im laufenden Etatsjahre, da in den ersten 10 Monaten bereits 2621 Proben eingegangen sind und monatlich etwa 230 Proben im Durchschnitt eingehen, die Zahl 3000 überschreiten.
Die folgende Übersicht gibt Aufschluß über die Art der Anfor- derungen an das Untersuchungsamt. Es handelte sich im Jahre.
1909 in
344 Fällen um den serologischen Nachweis des Typhus, 942 „ „ „ kulturellen Nachweis des Typhus, 511 „ „ „ Nachweis der Diphtherie (davon 51 mit
Tierexperiment),
581 „ ,, ,, Nachweis der Tuberkulose (davon 20 mit Tierexperiment),
184 „ „ „ serologischen Nachweis der Syphilis ' ( W a s s e r m a n n ) ,
78 „ „ „ kulturellen Nachweis der Genickstarre, 20 ,, „ „ serologischen Nachweis der Genickstarre, 54 „ „ „ Nachweis der Gonorrhöe,
12 „ „ „ kulturellen Nachweis der Ruhr, 3 „ „ „ serologischen Nachweis der Ruhr, ii ,, „ „ Nachweis des Milzbrands,
2 ,, „ eineUntersuchung von Wasser auf Mikroben i Falle um eine Nahrungsmitteluntersuchung,
48 Fällen um Verschiedenes (Malaria, Echinokokken, Eiter- erreger usw)..
Das, Material stammte in 203 Fällen von beamteten Ärzten,
!2i4«Einsendungen erfolgten von Privatärzten, 299 von Kliniken, 701 von den hessischen Landkrankenhäusern, 734 von verschie- denen Krankenanstalten usw. Positiv waren von den 2791 Unter- suchungen 660,- d. h. etwa 25 %, wie auch andernorts beob- achtet ist.
136 BDL Lab.med 14, Nr. 12: BDL 136 (1990)
Das Institut für Infektionskrankheiten Berlin verfügte be- reits über mehrere "fliegende Laboratorien".
Außerdem stehen hier die sogenannten „ f l i e g e n d e n L a b o r a t o r i e n " für Cholera, Pest und Typhus stets gebrauchsfertig,. In bequem tragbaren Koffern und Kisten ist hier das notwendigste Instru- mentarium eines bakteriologischen Laboratoriums, ein Mikroskop, Brutschrank mit Petroleumlampe, sterile Gläser, gebrauchsfertige.
Nährböden usw. verpackt, so daß bei dem plötzlichen Auftreten eines verdächtigen Krankheitsfalles auf Anordnung des Ministe- riums ein Beauftragter des Instituts ohne Verzug an Ort und Stelle die erforderlichen bakteriologischen Untersuchungen vor- nehmen kann.
Interessant ist ein Blick in die Organisation des Instituts.
Die O r g a n i s a t i o n des Instituts für Infektionskrank- heiten vereinigt das Prinzip der Arbeitsteilung mit dem der gemeinsamen einheitlichen Oberleitung. Die Leitung des ganzen wissenschaftlichen Betriebes obliegt dem Direktor. Für die Be- arbeitung der einzelnen Wissenszweige bestehen Abteilungen, die mit der Zeit vermehrt wurden und von ursprünglich zwei auf sieben angewachsen sind.
1. Die W i s s e n s c h a f t l i c h e A b t e i l u n g beschäf- tigt sich zur Zeit mit der Erforschung der Insekten, die als Krank- heitsüberträger beim Menschen bekannt sind, und ähnlichen Auf- gaben, sowie mit der Beaufsichtigung, Vermehrung und Instand- haltung der Sammlung und der Lehrmittel (Karten, Bilder usw.) und der Bibliothek.
2. Die S e u c h e n - A b t e i l u n g bearbeitet die morpho- logisch-bakteriologische Seite der Infektionskrankheiten. Sie bildet die Zentralstelle für Cholerauntersuchungen in Preußen.
Außerdem werden hier die 'diagnostischen, agglutinierenden und bakteriziden Sera für Typhus, Cholera, Dysenterie angefertigt und vorrätig gehalten, sowie die Untersuchungen für das Unter- suchungsamt ausgeführt, mit Einschluß der Serodiagnostik der Infektionskrankheiten.
3. Die A b t e i l u n g für S e r u m f o r s c h u n g pflegt das weite Gebiet der Immunitätsforschung. Hier wird außerdem das Genickstarre- und B o tulismus-Heilserum gewonnen und ver- sandfähig gehalten, die Serodiagnostik der Lues ausgeführt usw.
4. In der Abteilung für T r o p e n k r a n k h e i t e n . Tropen- hygiene und Protozoenkunde"werden zahlreiche auf diesen Ge- bieten noch der Klärung harrende Fragen bearbeitet.
5. Die W u t s c h u t z a b t e i l u n g befaßt sich mit der Er- forschung der Lyssa, der Diagnose bei verdächtigen Fällen und mit der Schutzimpfung der von wutkranken und wutverdächtigen Tieren verletzten Personen.
6. Die c h e m i s c h e A b t e i l u n g bearbeitet hygienische Fragen, soweit sie bakteriologisch-chemischer Natur sind, prüft Desinfektionsmittel und -Verfahren und unterstützt die anderen Abteilungen in allen chemischen Fragen, ebenso wie hier Chemi- kalien und Nährböden für den Institutsgebrauch angefertigt werden.
7. Die K r a n k e n a b t e i l u n g im R u d o l f V i r c h o w - Krankenhaus steht mit ihren 138 Betten im engsten Konnex mit dem Institut.
Jede Abteilung untersteht der Leitung eines auf dem betreffen- den Gebiet bewährten Forschers. Die Arbeitsgebiete sind nicht streng voneinander geschieden; denn gerade durch die häufige Berührung in Einzelfragen und durch regelmäßige gemeinsame Beratungen unter dem Vorsitz des Direktors wird der Fortschritt des Ganzen erfahrungsgemäß gefördert.
Für den Transport des Untersuchungsmaterials wurden ein- heitliche Versandgefäße hergestellt.
Mit dem Erlaß des preußischen G e s e t z e s , b e t r e f f e n d d i e B e k ä m p f u n g ü b e r t r a g b a r e r K r a n k h e i t e n , vom 28. August 1905 traten neue Aufgaben an die preußische Medizinalverwaltung heran. Um die Möglichkeit einer schnellen und sicheren Feststellung übertragbarer Krankheiten allen Teilen des Landes zu gewähren, gab sie zweckmäßige Muster von V e r - s a n d g e f ä ß e n für Untersuchungsmaterial an, zunächst für D i p h t h e r i e , G e n i c k s t a r r e , R u h r , T y p h u s u n d T u - b e r k u l o s e und lagerte eine Anzahl dieser Versandapparate in sämtlichen Apotheken des Landes. Jeder beamtete, jeder prak- tische Arzt in Preußen kann diese Apparate unentgeltlich ent- nehmen, und portofrei an die betreffende Untersuchungsstelle einsenden, um von ihr in kürzester Frist eine Mitteilung über das Ergebnis der Untersuchung zu erhalten. Preußen ist in dieser Beziehung für das übrige Deutschland vorbildlich gewesen.
Die Zahl der Hygiene-Institute und die aufgewandten Mittel stiegen ständig.
Beschränkten sich diese im Jahre 1883 auf das hygienische Uni- versitätsinstitut in München und Leipzig, das Kaiserliche Ge- sundheitsamt in Berlin und das Institut für medizinische Chemie und Hygiene in Göttingen, so hat sich seitdem ihre Zahl mehr als verzehnfacht, und in ähnlichem Verhältnis haben seitdem sich die Mittel vermehrt, die für die wissenschaftliche Forschung auf dem Gebiet der Hygiene und Infektionskrankheiten aufge- wendet wurden.
Eine Übersicht über die Zahl der untersuchten Proben im Deutschen Reich zwischen 1903 und 1909 zeigt die folgende Übersicht.
Die Z a h l der U n t e r s u c h u n g e n der einzelnen Medizinal- untersuchungsanstalten war in:
Potsdam Stettin Bromberg
Breslau . . . . Hannover . . Stade
Münster . . . . Coblenz Düsseldorf . . . Sigmaringen . .
1903
590 93
1904 416 349
—
263 I90S
640 420
—
S1? 2271
1906 1047 912
— 1605
628 2020947
1907 2552 2127 1076 1522 1767 3015 2877 389 2207*553 2108 39
1908 34553782 2CQ7 1928 3150 3767 641 3 26787 3595
253°
107 1909 3722 4630 2876 2137 3464 3768 6247 54°72837 27243486 141
Die Schwierigkeiten bei der Errichtung "hygienischer Lehr- stühle" beschreibt der Geh. Medizinalrat Prof. Dr. C. Flügge 1911 so:
1. Das Hygienische Institut der Universität Berlin.
.Von
Geh. Medizinalrat Prof. Dr. C. Flügge.
Im Jahre 1878 errichtete die bayrische Regierung in München das erste Deutsche Hygienische Institut und übertrug dessen Leitung P e t t e n k o f e r . Es lag damals die Erwartung nahe, daß nunmehr auch an den übrigen Deutschen Universitäten diese jüngste medizinische Disziplin eine Stätte finden werde. Aber gegenüber den von mancher Seite erhobenen Bedenken, ob auch wirklich die Lebensfähigkeit und die Bedeutung der experimen- tellen Hygiene als Lehrfach und als Forschungsgebiet feststehe, bedurfte es eines weiteren kräftigen Anstoßes, um die Regie- rungen zur Begründung selbständiger hygienischer Lehrstühle und Institute an den Universitäten zu veranlassen. Dieser Anstoß ging aus von den Arbeiten des unvergeßlichen R o b e r t K o c h . 1858 erschien die Anleitung zur pathologisch-chemischen Analyse von Dr. Felix Hoppe, dem ersten Assistenten am Lab.med. 14, Nr. 12: BDL137 (1990) BDL 137
pathologischen Institut und Privat-Dozenten an der Univer- sität zu Berlin (9). Es enthält 106 Analysenvorschriften zur Untersuchung von Körperflüssigkeiten und Gallensteinen.
Die Belege aus der Geschichte der Laboratoriumsmedizin zeigen, daß das Prinzip der Arbeitsteilung, der Gleichberech- tigung von Institut und Klinik, schärfer formuliert: die durch- gängige Unabhängigkeit der Labormedizin von der Klinik, das exponentielle Wachstum der Analysenzahlen und die Vorga- be der Rahmenbedingungen durch den Staat schon vor 90 Jahren üblich waren und sich glänzend bewährten.
Schon 1903 wurden labormedizinische Untersuchungen auf Einsendebasis vorgenommen, wobei nicht nur staatliche Stellen, sondern auch frei praktizierende Ärzte von dieser Möglichkeit Gebrauch machten.
Durchgeführt wurden diese Untersuchungen unter anderem von Hygiene-Instituten, Instituten für Physiologische Chemie bzw. Pathologie, Medizinaluntersuchungsämtern, Kreisärz- ten, Medizinaluntersuchungsstellen und Untersuchungsan- stalten.
Literatur:
1. Internationale Hygiene-Ausstellung Dresden 1911. Einrichtungen auf dem Gebiete des Unterrichts- und Medizinalwesens im Königreich Preußen. Commissionsverlag von Gustav Fischer, Jena. Die preußi- schen Medizinaluntersuchungsämter. Dr. Doepner, Berlin. S. 211-213.
2. A., o. O.
Das Institut für Hygiene und experimentelle Therapie zu Marburg. Wirkl.
Geh. Rat Prof. Dr. E. v. Behring. S. 76-77.
3. A. o. O.
Das Königl. Institut für Infektionskrankheiten in Berlin. Geh. Obermedi- zinalrat Prof. Dr. Gaffky. S. 91-92.
4. A. o. O. S. 96-98.
5. A. o. O. Einleitung. M. Kirchner. S. XI.
6. A. o. O. Einleitung. M. Kirchner. S. IX.
7. A. o. O.
Die preußischen Medizinaluntersuchungsämter. Dr. Doepner, Berlin.
S. 216.
8. A. o. O.
Das Hygienische Institut der Universität Berlin. Geh. Medizinalrat Prof.
Dr. Flügge. S. 3.
9. Anleitung zur pathologisch-chemischen Analyse für Ärzte und Stu- dierende von Dr. Felix Hoppe. Berlin, 1858. Verlag von August Hirschwald. 69. Unter den Linden (Ecke der Schadowstr.).
R. H. Seuffer, Reutlingen
Mitteilungen
Änderung der Mutterschafts-Richtlinien
Der Bundesausschuß der Ärzte und Krankenkassen hat in seiner Sitzung am 22. Juni 1990 beschlossen, einige Ände- rungen an den Mutterschafts-Richtlinien vorzunehmen (Ver- öffentlicht im Dt. Ärzteblatt 87, Heft 37,13: September 1990, Seite A-2738).
Dabei enthält in Abschnitt C die Nummer 2. folgende Fas- sung:
"2. Ein weiterer Antikörpersuchtest ist (bei Rh-positiven Schwangeren) in der 24. bis 29. Schwangerschaftswoche durchzuführen. Bei R'h-negativen Schwangeren ist der wei- tere Antikörpersuchtest in der 28. oder 29. Schwanger- schaftswoche durchzuführen. Bei diesen Schwangeren soll unmittelbar im Anschluß an die Blutentnahme für diesen
Antikörpersuchtest Anti-D-lmmunglobulin injiziert werden, um möglichst bis zur Geburt eine Sensibilisierung der Schwangeren zu verhindern. Das Datum der präpartalen Anti-D-Prophylaxe ist im Mutterpaß zu vermerken,"
Demnach sind auch bei Rh-negativen Patientinnen in Zukunft nur noch zwei Antikörperbestimmungen in der Schwanger- schaft vorgesehen, und zwar zu Beginn sowie in der 28. bzw.
29. Schwangerschaftswoche. Der bisher vorgesehene dritte Antikörpersuchtest entfält. Dagegen ist bei allen Rh-negati- ven Schwangeren unmittelbar nach der Blutentnahme für den zweiten Antikörpersuchtest in der 28. oder 29. Schwanger- schaftswoche eine zusätzliche präpartale Anti-D-Prophylaxe vorgesehen. Man geht davon aus, daß damit bis zum Entbin- dungstermin ein ausreichender Schutz gewährleistet ist.
Ausschuß Qualitätssicherung
Bundesärztekammer und Kassenärztliche Bundesvereinigung haben einen gemeinsamen Ausschuß "Qualitätssicherung"
' gegründet. Diesem Ausschuß sollen angehören: seitens der Bundesärztekammer deren Präsident Dr. Karsten Vilmar, Vizepräsident Dr. Gustav Osterwald (der im BÄK-Vorstand zugleich für Fragen der Qualitätssicherung zuständig ist) und Dr. Rolf Bialas; seitens der Kassenärztlichen Bundesvereini- gung deren Erster Vorsitzender Dr. Ulrich Oesingmann, der Zweite Vorsitzende Dr. Otfrid P. Schaefer und Dr. Eckhard Weisner (im KBV-Vorstand zugleich zuständig für Fragen der Qualitätssicherung).
Ärztestatistik
Die nachfolgenden Angaben wurden den "Grunddaten zur kassenärztlichen Versorgung in der Bundesrepublik Deutsch- land 1990", herausgegeben von der Kassenärztlichen Bun- desvereinigung - Referat für Volkswirtschaft und Statistik - entnommen.
Die Gesamtzahl der Kassen-/Vertragsärzte betrug im Jahr 1989 69.861 gegenüber 68.495 im Jahr 1988, was einer Zunahme von 2,0 % entspricht.
Dabei stieg die Zahl der Allgemein-/Praktischen Ärzte um 1,4 % auf 29.336, die der Ärzte mit Gebietsbezeichnung um 2,4 % auf 40.525.
Der Anteil der Gebietsärzte nahm in den letzten Jahren gegenüber den Allgemein-/Praktizierenden Ärzten langsam zu. Betrug er 1974 noch 49 %, so ist er bis 1989 auf 58 % angestiegen.
Eine abnehmende Tendenz zeigt seit 1983 die Altersgruppe der 60jährigen und älteren, die von 29,0 % im Jahr 1982 auf 15,5 % im Jahr, 1989 zurückging.
Die Gesamtzahl der an der Kassenärztlichen Versorgung teil- nehmenden Laborärzte ging von 532 im Jahr 1988 auf 524 im Jahr 1989 zurück (= -1,5 %). Es ist die einzige Arztgruppe, deren Zahl sich, bei einem durchschnittlichen Anstieg aller Arztgruppen um 1,6 % verminderte. Bei den Kassen-/Ver- tragsärzten nahm die Zahl der Laborärzte allerdings von 345 auf 354 (= +2,6 %) zu. '
Am Leistungsbedarf (BMÄ/E-GO) insgesamt (Honoraranfor- derung in Punkten) war im Jahr 1988 das Labor mit 11,4 % beteijigt. Auf die Basisuntersuchungen entfielen 6,5 %, auf die speziellen Untersuchungen 4,9 %.
Von den abgerechneten Laborleistungen erbrachten 1988 die Allgemein-/Praktizierenden Ärzte 27,3 %, danach folgen die Laborärzte mit 25 %, die Internisten mit 24 %, die Frauenärzte mit 7,6%, die Urologen mit 5,2% und die Kinderärzte mit 2,1 %:
138 BDL Lab.med. 14, Nr. 12: BDL 138 (1990)
Vergütung der Behandlung von Patienten aus der ehemaligen DDR
Die Kassenärztliche Bundesvereinigung und die Spitzenver- bände der Krankenkassen haben sich über die Grundlagen der Vergütung kassenärztlicher Leistungen in den zur Bun- desrepublik beigetretenen fünf Ländern einschließlich Ost- Berlin nach dem 1.1.1991 geeinigt. Zu diesem Zeitpunkt tritt das SGB V in Kraft. Für die Übergangszeit vom 3.10.1990 - 31.12.1990 wurde folgendes vereinbart:
Kommt ein Patient aus den beigetretenen fünf Bundeslän- dern einschlie ßlich Ost-Berlin zur Behandlung, so mu ß ersieh durch Vorlage des Sozialversicherungsausweises als Versi- cherter der Krankenversicherung ausweisen. Die Abrech- nung der ärztlichen Leistungen erfolgt von einem vom Be- handler ausgestellten Überweisungsschein. Dieser muß vom Versicherten unterschrieben werden. Im Kostenträgerfeld ist
"SVK" einzutragen.
Die Abrechnung erfolgt nach dem BMA und wird mit einem Punktwert von 6,1 Pfg vergütet. Wenn eine Leistung nach diesem Vergütungssatz erbracht wird, kann vom Patienten als Voraussetzung für die Übernahme der Behandlung eine Zuzahlung in Höhe von 3,9 Pfg je Punkt verlangt werden, mit Ausnahme der Laborleistungen, für die eine Zuzahlung in Höhe von 0,9 Pfg je Punkt verlangt werden kann.
Ist die Behandlung einer akuten Erkrankung unaufschiebbar oder ist eine Leistungserbringung in der BRD durch die Krankenkasse vorher genehmigt worden, erfolgt die Vergü- tung mit einem Punktwert von 10 Pfg mit Ausnahme der Laborleistungen, für die ein Punktwert von 7 Pfg festgelegt wurde.
AIDS-Bekämpfung in der Bundesrepublik Deutschland
Unter diesem Titel hat das Bundesministerium für Jugend, Familie, Frauen und Gesundheit eine Broschüre herausgege- ben, inderauf die Probleme der Erkrankung, ihre Ausbreitung und Häufigkeit und vor allem die Maßnahmen des Ministe- riums eingegangen wird. Es werden der Koordinierungsstab AIDS, der Nationale AIDS-Beirat, die Enquete-Kommission des Deutschen Bundestages, das AIDS-Zentrum beim Bun- desgesundheitsamt und weitere auch nichtstaatliche Organi- sationen'und deren Aktivitäten vorgestellt.
Einige Dokumente und_ein Adressenverzeichnis von An- sprechpartnern schließeri'die Veröffentlichung ab.
Die Broschüre (100 Seiten) kann kostenfrei beim Bundesmi- nisterium für Jugend, Familie, Frauen und Gesundheit, Post- fach 20 02 20, 5300 Bonn 2 angefordert werden.
Verfahrensrichtlinien für die mikrobiologische Diagnostik
Nachstehende Verfahrensrichtlinien für die mikrobiologische Diagnostik (DGHM-Verfahrensrichtlinien) wurden von ver- schiedenen Arbeitsgruppen der Kommission der Deutschen Gesellschaft für Hygiene und Mikrobiologie erarbeitet und im Zentralblatt für Bakteriologie veröffentlicht:
Isolierung und Identifizierung von Dermatophyten Arbeitsgruppe 2.18 (Obmann Prof. Dr. Wolf Meinhof, Aachen)
Zbl. Bakt. 273, 229-245 (1990) Anaerobe gramnegative Stäbchen
Arbeitsgruppe 2.7 (Obmann Prof. Dr. H. Werner, Tübingen) Zbl. Bakt. 273, 246-260 (1990)
Die Empfindlichkeitsbestimmung von Bakterien gegen Chemotherapeutika
Arbeitsgruppe 4.2 (Obmann Prof. Dr. G. Linzenmeier, Essen) Zbl. Bakt. 273, 261 -276 (1990)
Hygienebeauftragte und Hygienefachkräfte
Das Medizinische Landesuntersuchungsamt Stuttgart führt im Jahi; 1991 folgende Veranstaltungen für Hygienebeauf- tragte und Hygienefachkräfte durch:
Hygienebeauftragte
Fortbildungskurs für Hygienebeauftragte 25. 11.91 -29. 11.91
Fortbildungstagung 09. 12.91 - 10. 12.91 Hygienefachkräfte
Weiterbildungskurse l für Hygienefachkräfte 14.01.91 -22.02.91
02.09.91 -11. 10. 91 Weiterbildungskurs II 15.04.91 -26.04.91 Weiterbildungskurs III 17.06.91 -28.06.91 Weiterbildungskurs IV 01.07.91 -12.07.91 04.11.91 -15. 11.91
EDV-Ergänzung 03. 06. 91 - 07. 06. 91 Fortbildungstagung für Hygienefachkräfte 18. 11.91 -19. 11.91
Anmeldungen sind zu richten an:
Medizinisches Landesuntersuchungsamt Prof. Dr. med. W. Steuer, Ltd. Med. Direktor Wiederholdstr. 15, 7000 Stuttgart 1
Strahlenschutzkurse
Das Kernforschungszentrum Karlsruhe GmbH bietet im Jahr 1991 folgende Kurse an:
Grundkurs im Strahlenschutz für Ärzte
(gemäß StrISchV und RöV sowie der entspr. Richtlinien) Kursdauer
Kursgebühr Kursleiter Termine : 62. Kurs 63. Kurs 64. Kurs 65. Kurs 66. Kurs
3 1/2 Tage (24 Stunden) DM 880,-
Dr. H. Kleinfeld 28. 01.-31. 01. 1991 11.03.- 14. 03. 1991 18. 06.-21. 06. 1991 16.09.- 19.09. 1991 28. 10.-31. 10.1991
Spezialkurs im Strahlenschutz beim Umgang mit offenen radioaktiven Stoffen für Ärzte
(gemäß StrISchV und Richtlinie "Strahlenschutz in der Medi- zin")
Voraussetzung: Besuch des Grundkurses im Strahlenschutz für Ärzte
Kursdauer Kursgebühr Kursleiter
4 Tage (24 Stunden) DM 880,- bzw. DM 740,·
Dr. H. Kleinfeld
'Die Kursgebühr ermäßigt sich auf DM 740,-, wenn innerhalb von 2 Jahren auch der Grundkurs im Strahlenschutz für Ärzte in der Schule für Kerntechnik besucht wurde.
Termin: 24. Kurs 22. 04. - 25. 04. 1991
Lab.med. 14, Nr. 12:BDL 139 (1990) BDL 139
Die neue Strahlenschutzverordnung und ihre Auswir- kung im medizinischen Bereich
Kursdauer Kursgebühr Kursleiter Termin
1 Tag DM 300,- Dr. H. Kleinfeld 01.03. 1991
Dieser Kurs wendet sich an Ärzte bzw. Strahlenschutzbeauf- tragte, welche im medizinischen Bereich Umgang mit (offe- nen) radioaktiven Stoffen haben (Nuklearmedizin, Labordia- gnostik etc.) und die sich über die novellierte Strahlenschutz- verordnung informieren wollen.
Diese Kurse sind Strahlenschutzveranstaltungen für Ärzte für den Strahlenschutz im medizinischen Bereich.
Sie dienen dem Nachweis der Fachkunde im Sinne der Strahlenschutzverordnung und der Röntgenverordnung.
Nach Kursinhalt und Dauer entsprechen sie den zur Durch- führung der Strahlenschutzverordnung und Röntgenverord- nung erlassenen Richtlinien.
Aus anderen Zeitschriften
Donnerstag, den 7. März 1991
Labordiagnostik im Jahr 2000 Blutgruppenserologie Die Niere (Rö) Histologie
Spezielle Aspekte der Immunologie Pankreasdiagnostik Aktuelle Liquordiagnostik Nuklearmedizin - Tumor-
marker
Strahlentherapie Röntgendiagnostik in der Neuroradiologie HNO-Klinik
Freitag, den 8. März 1991 Morphologische Hämatologie
Radiologisch-diagnostische und Fettstoffwechsel Kommunikation im Kran- kenhaus
therapeutische Maßnahmen in der Hämostaseologie Traumatologie Mikrobiologie Interventionelle Radiologie . EDV-Seminar Hormonrezeptoranalytik Prä- und perinatale Schilddrüsendiagnostik Infektionsdiagnostik Strahlentherapie
Seminare:
Zytologie/Hämatologie/Parasitologie/Radiologie
Auskunft: dvta e. V. - Geschäftsstelle, Spaldingstr. 11 Ob, 2000 Hamburg 1.
Schadenersatz wegen falschem Labortest .
Der Kassenarzt berichtet in Nr. 43 (Oktober) 1990:
Einer Französin sind von einem Gericht in Colmar (Elsaß) 100.000 Franc (29.850 Mark) Schadenersatz zugesprochen worden, weil sie nach falschen, positiven Aids-Tests ein Kind abgetrieben hatte....
Nach dem Urteil müssen ein Labor in Colmar und das Pasteur-lnstitut in Paris den Schadenersatz zahlen, da sie in Tests fälschlicherweise eine Aids-Infektion festgestellt hatten, verlautete aus Justizkreisen. Ein weiterer Aids-Test fiel erst negativ aus, als das Kind bereits abgetrieben
Personalien
Dr. Dr. E. Hartter, Oberarzt an der II. Medizinischen Universitätsklinik Wien, wurde die Lehrbefugnis als Univ.-Dozent für Medizinische und Chemische Labordiagnostik verliehen.
Dr. med. habil. A. K. Walli, Ph. D., Professor für Klinische Chemie der Universität Göttingen, ist zum C3-Professor für klinische Chemie und Pathobiochemie ernannt worden.
Dr. J. D. Kruse-Jarres, außerplanmäßiger Professor für klinische Che- mie und klinische Biochemie Tübingen, ärztlicher Direktor und Chefarzt des Instituts für klinische Chemie und Laboratoriumsmedizin des Ka- tharinenhospitals Stuttgart, wurde die Ehrenmitgliedschaft der Italieni- schen Gesellschaft für Laboratoriumsmedizin verliehen.
Für die MTA/MTL
6. Deutscher MTA-Kongreß
veranstaltet vom Deutschen Verband Technischer Assisten- ten in der Medizin e. V. (dvta)
Vom 6. bis 8. März 1991 im Kongreßzentrum Rosengarten, Mannheim
Hauptthemen:
Mittwoch, den 6. März 1991
Marketing im Labor Durchflußzytometrie Röntgenverordnung und Nuklearmedizin
Qualitätssicherung Viruserkrankungen des ZNS Digitale Radiographie
Buchbesprechungen
Praktikum der Parasitosen
Tierische Parasitosen des Menschen und ihre Serodiagnose. Hrsg.
von Oswald Zwisler, autorisiert vom Internationalen Grünen Kreuz, Genf. 3. überarb. Auflage, 239 S., geb. Hoffmann Verlag Berlin, 1988.
ISBN 3-87344-040-7. DM35,80.
Entsprechend dem Untertitel wird in der ersten Hälfte des Buches der serologische Nachweis wichtiger Parasitosen abgehandelt. Unter Berücksichtigung neuerer Verfahren wie RIA und ELISA, auch unter Anwendung monoklonaler Antikörper, wird anhand umfangreicher Li- teraturangaben, die bis zum Jahr 1987 reichen, zur Wertigkeit der einzelnen Methoden Stellung genommen. Im zweiten Teil des Ta- schenbuches werden die wichtigsten Parasitosen eingeteilt in Erkran- kungen, die durch Protozoen, Trematoden, Cestoden und Nematoden hervorgerufen werden, stichwortartig dargestellt. Dabei werden meist die 11 Punkte: Krankheitsbild, Häufigkeit und Verbreitung, Ätiologie, Dauer der Ansteckungsfähigkeit, Inkubationszeit, Diagnose, Differen- tialdiagnose, Immunität, Behandlung, Prophylaxe und weitere Maß- nahmen berücksichtigt.
Auf Abbildungen wird ganz verzichtet. Die serologischen Methoden werden zwar in ihrer Bedeutung dargestellt, nicht jedoch wird auf ihre praktische Durchführung eingegangen, so daß der Titel "Praktikum"
etwas irreführend ist.
Das Büchlein ist jedoch nützlich für den, der sich informieren will, welche Reaktion er bei einer bestimmten Erkrankung anwenden oder anfordern soll.
W. Hauck, Karlsruhe
Handkommentar BMA, -GO und GOA
Loseblattausgabe, 6. Auflage, 13. Ergänzungslieferung - Stand 1.
Oktober 1990. Von H. Wezel(=) und R. Liebold. 184 S. Asgard-Verlag Dr. Werner Hippe KG, Sankt Augustin, 1990. ISBN 3-537-53413-2. DM 31,- Preis des Gesamtwerkes DM 98,-.
Die neue Quartalslieferung bringt nur kleine Änderungen, um den Kommentar auf aktuellem Stand zu halten. So sind Punktionsnadeln, soweit sie speziell der Entnahme von Organgewebe zur histologischen oder ggf. auch zytologischen Untersuchung dienen und sofern es sich um Einmalartikel handelt, gesondert berechnungsfähig. Die Übermitt- lung eines Befundberichtes, der schriftlich zu erfolgen hat, ist nach dem Kommentar auch per Telefax möglich.
Im Laborteil finden sich einige Ergänzungen. So die Bemerkung, daß, wenn beim orientierenden Pilznachweis (Nr. 3887) auch orientierend Bakterien nachgewiesen werden, hierfür nicnts zusätzlich berechnet werden kann. Bei der Nr. 3916 sind für die vergleichende hämatologi- sche Begutachtung von Knochenmark und Blutausstrich auch evtl. zy- 140 BDL Lab.med. 14, Nr. 12: BDL 140 (1990)