Fachbereich Chemie Lehramt
Wintersemester 2006/2007
Experimentalvortrag Anorganische Chemie
„Metalle in Lebewesen“
01.02.2007 Birgit Schubert
Am Richtsberg 64 35039 Marburg
Ca
2+Inhaltsverzeichnis
Inhaltsverzeichnis 2
1. Allgemeine Einführung
1.1 Welche Elemente zählen zu den Metallen
3 3 2. Metalle in Lebewesen
2.1 Biologische Funktionen von Metall-Ionen 2.2 Versuch 1: Calciumnachweis in Knochen
2.2.1 Rund ums Calcium - Physiologisches 2.3 Demonstration 1: Giftige Wirkung des Bleis
2.3.1 Rund ums Blei – Physiologisches 2.3.2 Versuch 2: Hemmung der α-Amylase 2.4 Rund ums Eisen – Physiologisches
2.4.1 Versuch 3: Atmungskette
2.4.2 Versuch 4: Enzymatische Wirkung der Katalase 2.5 Rund ums Magnesium – Physiologisches
2.5.1 Versuch 5: Magnesiumnachweis
2.5.2 Demonstration 2: Dünnschichtchromatographie
5 6 6 8 10 11 12 17 18 22 24 24 27
3. Schulrelevanz 30
4. Abschlussbetrachtung 31
1. Allgemeine Einführung
Das Thema „Metalle in Lebewesen“ fällt in den Bereich der Bioanorganik. Der Begriff
„Bioanorganik“ beinhaltet einen scheinbaren Widerspruch, zum einen das Wort „bio“, welches sich vom griechischen Wort „bios“ ableitet, was Leben bedeutet und zum anderen den Begriff „anorganik“, die tote Materie. Dieser Widerspruch beruht auf der früheren fälschlichen Annahme, dass organische Materie nur aus lebenden Organismen gewonnen wird. Seit der Wöhlerschen Harnstoffsynthese 1828, in welcher aus dem anorganischen Stoff Ammoniumcyanat das organische Produkt Harnstoff entstand, weis man jedoch, dass man die Grenzen zwischen der Anorganik und der Organik nicht so eng ziehen darf. Auch der Begriff
„Bioanorganik“ zeigt den Zusammenhang zwischen dem Leben und anorganischer Materie.
(vgl. [W. Kaim, B. Schwederski, S.1])
Zunächst soll erst einmal kurz erörtert werden, welche Elemente zu den Metallen gehören.
1.1 Welche Elemente zählen zu den Metallen
Zu den Metallen zählt zunächst die erste Gruppe, die Alkalimetalle, ausgenommen vom Wasserstoff. Auch die zweite Gruppe gehört zu den Metallen, dies sind die sogenannten Erdalkalimetalle. Alle Elemente bis zur 12. Gruppe, die sogenannten Übergangsmetalle, sind, wie der Name schon sagt, Metalle. In der 13. Gruppe zählt man ab dem Aluminium alle Elemente zu den Metallen. In der 14. Gruppe zählen nur noch Zinn und Blei, in der 15.
Gruppe Bismut und in der 16. Gruppe nur noch das Zerfallsprodukt Polonium zu den Metallen.
Abb. 1: Periodensystem der Elemente,
[http://www.experimentalchemie.de/05-e-pse.htm]
Die Beziehung zwischen diesen anorganischen Elementen und dem Leben wird durch die folgenden zwei Diagramme veranschaulicht:
In diesen zwei Darstellungen sind die molaren Häufigkeiten von 3d-Elementen (in dem oberen Diagramm) und von Alkali- und Erdalkalimetallen (in dem unteren Diagramm) logarithmisch widergegeben. Die logarithmische Darstellung erfolgt nur zum besseren Erfassen der Mengenverhältnisse. Diese Metalle gehören zu den, für den Menschen, essentiellen Elementen. Man sieht im Vergleich, dass sie im Menschen in ähnlicher molarer Häufigkeit vertreten sind, wie im anorganischen Meerwasser. Dies ist jedoch nicht unlogisch, denn nach dem heutigen Wissensstand soll sich das Leben im Meer entwickelt haben.
Na
Abb. 2: Logarithmische Darstellung molarer Häufigkeiten von 3d-Elementen, [Prof. Bröring: Bioanorganik I;
Stunde 4]
Abb. 3: Logarithmische Darstellung molarer Häufigkeiten von Alkali- und Erdalkalimetallen, [Prof. Bröring: Bioanorganik I; Stunde 4; geändert durch die Vf.]
2. Metalle in Lebewesen
Metalle sind essentiell für das Leben auf der Erde. Das Schlüsselelement hierbei ist das Magnesium, welches als Zentralatom im Chlorophyll wichtig für die Photosynthese ist, ohne die wir keinen Sauerstoff zum Atmen hätten. Die Metalle kommen dabei in Form von Ionen in den Organismen vor.
Der menschliche Körper benötigt 14 Metalle, die er nicht selbst herstellen kann, diese werden als essentielle Metalle bezeichnet. Die Massen in einer 70 kg schweren Person sind in folgender Tabelle zu sehen:
Metall m [g]/70 kg Person Metall m [g]/70 kg Person
Ca 1000 Sn 0,02
K 140 V 0,02
Na 100 Cr 0,014
Mg 25 Mn 0,012
Fe 4,2 Mo 0,005
Zn 2,3 Co 0,003
Dabei nimmt der Körper fälschlicherweise mehr Metalle, aufgrund deren Ähnlichkeit zu den essentiellen Metallen (in Größe und Wertigkeit), auf.
Auffallend ist die große Masse von 1 kg, die Calcium im menschlichen Körper einnimmt.
Hingegen nehmen die blau markierten Metalle nur sehr geringe Massen ein. Diese Elemente zählen zu den sogenannten Spurenelementen. Diese sind chemische Stoffe, von denen kleinste Mengen, das heißt unter 25 mg, vom menschlichen Körper benötigt werden, um lebensnotwendige Stoffwechselprozesse aufrecht zu erhalten (vgl. 8W. Kaim, B.
Schwederski, S.8]). Diese Definition ist jedoch nur auf den Menschen abgestimmt, bei anderen Organismen variiert die Menge zwischen 1 mg bis 2500 mg (vgl. [N. A. Campbell, S.
894]).
2.1 Biologische Funktionen von Metall-Ionen
Abb. 4: Die 14 für den Menschen essentiellen Metalle, (vgl. [J. Emsley, S.34]; Hervorhebung durch die Vf.)
Die Metall-Ionen nehmen zahlreiche Funktionen im Körper ein, die man grob wie folgt einteilen kann:
Strukturfunktion Regel- und Signalfunktion
Strukturaufbau Strukturstabilisierung Informationsleitung Gradientenaufbau Regulation
Als Beispiel für den Strukturaufbau sei hier die Biomineralisation genannt, die zum Beispiel durch Calcium-Ionen (in Skeletten oder Zähnen) gewährleistet wird. Die Strukturstabilisierung durch Metall-Ionen findet zum Beispiel bei Enzymen oder sogar bei dem Polyanion DNAn- oder RNAn- statt. Die unter die Regel- und Signalfunktion fallende Regulation beinhaltet unter anderem alle Energiestoffwechselprozesse, welche zum Beispiel durch Elektronenübertragung an redoxaktive Metallzentren erfolgen. Von einer solchen Elektronenübertragung sei im späteren Verlauf noch die Rede. Unter die Informationsleitung fallen, neben anderen, die Nervenleitung und Wahrnehmung. Bei dem Gradientenaufbau sei kurz die Na/K-Pumpe, eine Membran-überspannende Ionenpumpe, welche über elektrochemische Potentialsprünge die Informationsleitung gewährleistet, erwähnt. (vgl.
[Prof. Bröring: Bionanorganik I; Stunde 4])
Da Calcium einen so hohen Stellenwert in Organismen einnimmt, möchte ich mit dem ersten Versuch darauf näher eingehen:
2.2 Versuch 1: Calciumnachweis in Knochen Chemikalien:
- 100 g entfettete Hähnchenknochen
- ca. 100 mL 5% HCl(aq) - 25% NH3(aq)
- verd. CH3COOH(aq) - 3% (NH4)2C2O4-Lsg.
Gefahrensymbole/R- und S-Sätze:
Chemikalie R-Sätze S-Sätze Gefahrensymbol
Abb. 5: Biologische Funktionen von Metall-Ionen, (vgl. [Prof. Bröring: Bionanorganik I; Stunde 4])
HCl(aq) 5%ig
NH3(aq) 25%ig 26-36/37/39-45-61 C, N
CH3COOH(aq) verd.
(NH4)2C2O4-Lsg. 3%ig Materialien:
- Mörser und Pistill
- Kneifzange
- Teesieb
- 2 Trichter
- 2 Faltenfilter
- 2 Erlenmeyerkolben
- 3 Pipetten
- 200 mL Messzylinder
- Indikatorpapier Durchführung:
Die entfetteten Knochen werden mit der Kneifzange zerkleinert und im Mörser mit dem Pistill zerrieben. Auf die zermörserten Knochen werden etwa 100 mL 5% HCl(aq) gegeben und ungefähr fünf Minuten einwirken gelassen. Danach filtriert man das erste Mal ab. Aufgrund der größeren Knochenreste ist es besser, die groben Bestandteile über ein Teesieb abzutrennen und dann erst mittels einem Faltenfilter in einen Erlenmeyerkolben abzufiltrieren. Das Filtrat wird leicht mit 25% NH3(aq) alkalisch gemacht. Da dabei ein Niederschlag ausfällt, muss noch einmal abfiltriert werden. Dieses Filtrat säuert man leicht mit der verdünnten Essigsäure an und tropft dann solange Ammoniumoxalat-Lösung dazu, bis ein weißer Niederschlag zu sehen ist.
Beobachtung:
Nach Zugabe des Ammoniaks fällt ein weißlich bis durchsichtiger Niederschlag aus. Beim Zutropfen der Ammoniumoxalat-Lösung fällt ein weißer Niederschlag aus.
Auswertung:
Knochen bestehen hauptsächlich aus Hydroxyapatit. Dieser wird durch die Protonen der Salzsäure gelöst:
Ca5(PO4)3OH(s) + H3O+(aq) 5 Ca2+(aq) + 3 PO43-
(aq) + 2 H2O
Durch die Zugabe von Ammoniak fallen organische Bestandteile aus. Durch leichtes ansäuern mit der 5% Essigsäure entsteht ein Ammoniumacetat-Puffer, welcher von Nöten ist, um die Calcium-Ionen später nachzuweisen. Der Ammoniak liegt dabei in dissoziierter Form vor:
CH3COOH(aq) + NH4+
(aq) + OH-(aq) NH4+
(aq) + CH3COO-(aq) + H2O Der eigentliche Nachweis der Calcium-Ionen erfolgt nun mit den Oxalat-Ionen aus der Ammoniumoxalat-Lösung:
Ca2+(aq) + C2O42-
(aq) CaC2O4(s)↓
Dabei fällt das Calciumoxalat als weißer Feststoff aus.
2.2.1 Rund ums Calcium – Physiologisches
Das Calcium ist ein Element der 2. Gruppe, es ist also ein Erdalkalimetall. Der Mensch benötigt pro Tag in etwa 500 mg davon. Diese Menge kann er am ehesten über Milchprodukte, Eier und Hülsenfrüchte aufnehmen. (vgl. [J. Emsley, S.38])
Die Calcium-Ionen tragen im Körper vor allem zur Knochen- und Zahnbildung bei. Zähne bestehen auch aus Apaptit, jedoch ist hier das Hydroxid des Hydroxyapatit zum Teil durch Fluorid ersetzt. Eine weitere Hauptfunktion ist die Nerven- und Muskelfunktion.
Verschiedene Ca2+-Pumpen sind so zum Beispiel der Hauptbestandteil des sarkoplasmatischen Retikulums in Muskelzellen. Durch einen elektrischen Nervenreiz findet eine Membrandepolarisation statt. Dadurch wird Ca2+ aus den Calsequestrinen (Speicherproteinen) im sarkoplasmatischem Retikulum freigesetzt (dieser Vorgang ist noch nicht genau geklärt).
Außerdem sind Calcium-Ionen an der Blutgerinnung beteiligt. Die Calcium-Ionen liegen dabei frei im Plasma vor. Das Calcium-Ion ist ein Bindeglied zwischen den negativ geladenen Phospholipiden (Zellmembrane) und den ebenfalls negativ geladenen Gerinnungsfaktoren.
Dadurch erfolgt eine Konzentrationsanreicherung dieser Gerinnungsfaktoren am Ort der Wundheilung. Nur unter Ca2+ Anwesenheit kann die inaktive Form des Thrombins, das Prothrombin, in seine aktive Form gespalten werden. Dieses ist wiederum notwendig, da es die Reaktion des Fibrinogens zu Fibrin katalysiert. Durch die Bildung von Fibrinpolymeren
wird ein stabiles Geflecht zum Wundverschluss erreicht, da dieses nicht mehr im Plasma löslich ist (vgl. [Campbell, S. 913 f.]). Da das Skelett nie in konstanter Form vorliegt, sondern einem ständigen Auf- und Abbau durch die Osteoblasten und Osteoklasten unterliegt, ist eine sekundäre Funktion die Konstanthaltung des Calcium-Ionenspiegels im Blut. So kommt es bei Mangel an Ca2+-Ionen unter anderem zu einem vermindertem Wachstum und dem Verlust an Knochensubstanz, eine zu hohe Konzentration hingegen führt z.B. zu einer Muskelübererregbarkeit und somit zu Krämpfen.
Wie schon erwähnt besteht der menschliche Körper aus Hydroxyapatit, dieser ist hart und schwer löslich in Wasser. Der menschliche Körper besteht aus etwa 9 kg Knochen. Davon sind ~2,5 g Phosphat und ~1 kg Ca2+-Ionen. Dieses eine Kilogramm macht etwa 99% des Gesamtgehalts an Calcium-Ionen im Körper aus. Der Rest besteht aus Wasser, Collagen und anderen Metall-Ionen wie Na+, K+, Fe3+ und Pb2+. Dabei wird das Blei fälschlicherweise vom Körper aufgenommen. Der heutige Bleigehalt im Knochenspiegel liegt bei etwa 2 ppm, früher reichte er sogar bis zu 100 ppm (vgl. [J.Emsley, S.34]). Dies liegt daran, dass schon zu Zeiten der römischen Kultur viele Gefäße aus Bleiverbindungen bestanden, Wein wurde mit Bleiacetat versetzt und auch andere Lebensmittel damit gesüßt. Dies hatte zur Folge, dass viele Frauen infertil wurden. Blei fand später vielfältige Anwendung, so wurden zum Beispiel Wasserrohre aus Blei hergestellt, Lebensmitteldosen mit Bleilot verschlossen und Anstriche aus Bleiverbindungen hergestellt. Den größten Umweltbelastungsfaktor bildete Blei in Form von Tetraethylblei und Tetramethylblei in verbleitem Benzin, in welchem es als Antiklopfmittel diente. Dieses wurde mittlerweile in sehr vielen Ländern verboten, zuletzt in China. In Ungarn wurde das rote Blei(II)-oxid bis 1994 sogar im roten Paprikapulver verwendet. Dass die Bleiverwendung in so vielen Bereichen verboten wurde, liegt in seiner giftigen Wirkung. Eine solche giftige Wirkung möchte ich mit der folgenden Demonstration zeigen.
2.3 Demonstration 1: Giftige Wirkung des Bleis Chemikalien:
- Kresse-Samen
- Watte
- Wasser
- Bleiacetat-Lösung
Gefahrensymbole/R- und S-Sätze:
Chemikalie R-Sätze S-Sätze Gefahrensymbol Pb(CH3COO)2 61-20/21-33-50/53-62 45-53-60-61 T, N
Materialien:
- 4 100 mL Bechergläser
- Spatel Durchführung:
In drei Bechergläser füllt man etwas Watte, so dass der Boden gut bedeckt ist. Darauf gibt man nun je die gleiche Menge an Kressesamen. Das eine Becherglas gießt man normal mit Leitungswasser, in das andere Becherglas gibt man Bleiacetat-Lösung. Das dritte Becherglas gießt man zunächst, bis die Samen gekeimt sind mit Leitungswasser und erst dann mit der Bleiacetat-Lösung. Dies lässt man nun so lange stehen, bis die Samen ein ansprechendes Wachstumsstadium erreicht haben, dabei sollte jeden Tag nachgeschaut werden (auch wegen des Wässerungsstatus).
Beobachtung:
Die mit Leitungswasser gegossenen Kressesamen sind gut gewachsen und zeigen eine satte Grünfärbung. Die gleich mit Bleiacetat-Lösung versehenen Samen sind nicht ausgekeimt und die Samen, die nach der Keimung mit Bleiacetat-Lösung gegossen wurden, zeigen gegenüber den normal gegossenen ein vermindertes Wachstum, sowie eine fahlere Farbe.
Auswertung:
Dies liegt daran, dass Blei die Zellvermehrung hemmt, auch die Chlorophyllsynthese wird gehemmt. Diese beiden Faktoren führen insgesamt zu dem verringerten Wachstum und der verminderten Grünfärbung. Bei der Chlorophyllsynthese werden genauer gesagt zwei Enzyme, δ-Aminolävulinsäure-Synthetase und die δ-Aminolävulinsäure-Dehydratase, in ihrer Funktionsweise gestört. (vgl. [PdN-Ch. 3/82, S. 87])
Dies zeigt, dass Blei nicht nur für den menschlichen Organismus schädlich ist.
2.3.1 Rund ums Blei – Physiologisches
Blei ist ein Element der 14. Gruppe. Die maximale Arbeitsplatzkonzentration darf bei
0,1 mg/m3 liegen. Die Folgen einer Bleikontamination sind im Anfangsstadium Müdigkeit, Erbrechen, Gewichtsverlust und Kopfschmerzen. Ein höheres Vergiftungsstadium führt zu Darmkoliken, das zentrale Nervensystem wird geschädigt, sowie auch die Nieren. Man leidet außerdem an Anämie und Nervosität, es bildet sich ein Bleisaum am Zahnfleischrand aus und die Fertilität ist gestört, das heißt, Frauen leiden entweder an Fehlgeburten oder sind ganz steril. (vgl. [A. F. Holleman, E. Wiberg, S. 975])
Die Müdigkeit und Anämie sind auch damit zu erklären, dass die beiden Enzyme δ- Aminolävulinsäure-Synthetase und δ-Aminolävulinsäure-Dehydratase gehemmt werden. Dies beruht darauf, dass die Chlorophyllsynthese und die Hämoglobinsynthese in ihren ersten Stufen gleich verlaufen. Durch die verminderte Hämoglobinbildung resultiert eine verminderte Sauerstoffbindung.
Im Bild ist Ludwig van Beethoven zu sehen, welcher in Folge einer Bleivergiftung, wie mittlerweile durch eine Haaranalyse nachgewiesen wurde, gestorben ist (vgl.
[www.3sat.de/nano/news/11258/index.html]).
Blei hat im Blut und weichem Gewebe eine Retentionszeit von etwa einem Monat, bei Einlagerung in die Knochen dagegen sogar 30-40 Jahre. Ausgeschieden wird es über Haare, Nägel, Schweiß und Urin. Wenn die Bleivergiftung akut ist, muss ein Komplexon injiziert werden, in diesem Fall eine Na2CaEDTA-Lösung. Dabei werden leider auch andere essentielle Elemente vom EDTA komplexiert, so dass es zu deren Mangel führen kann.
Wie Blei im Organismus, durch die Hemmung von Enzymen, wirkt, sei exemplarisch mit dem 2. Versuch gezeigt.
2.3.2 Versuch 2: Hemmung der α-Amylase
Abb. 6: Ludwig van Beethoven, [www.beethoven-france.org]
Die α-Amylase (siehe Bild) ist ein Enzym, welches im Speichel enthalten ist. Auch im Pankreas wird es gebildet, so dass es im Dünndarm wirken kann.
Zu sehen sind die α-Helices (pink),
sowie die β-Faltblätter (gelb), welche über Schleifen (blau) miteinander verbunden sind. In der Mitte befindet sich das aktive Zentrum in Form einer Tonnen-Domäne.
Chemikalien:
- Speichel
- 3 mL 0,01% Pb(NO3)2-Lsg.
- 3 mL 0,01% Mg(NO3)2-Lsg.
- 40 mL 0,001% Stärke-Lsg.
- CaCl2(s)
- Lugolsche Lösung (5g I2 + 10 g KI in 100 mL H2Odest.)
Gefahrensymbole/R- und S-Sätze:
Chemikalie R-Sätze S-Sätze Gefahrensymbol
Pb(NO3)2(aq) 0,01%ig 61-20/21-33-50/53-62 45-53-60-61 T, N
Mg(NO3)2(aq) 0,01%ig 8 24/25 O
CaCl2(s) 36 22-24 Xi
Lugolsche Lsg.
Materialien:
- 4 Demonstrationsreagenzgläser
- Demonstrationsreagenzglasständer
- Spatel
- großes Becherglas
Abb. 7: α-Amylase, [www. zum.de/Faecher/Materialien/beck/bilder/amlase.gif]
- Bunsenbrenner
- Dreifuß mit Asbestdrahtnetz
- Waage
- 10 mL Messpipette
- Peleusball
- Pipette
- Glasstab
- 2 100 mL Bechergläser Durchführung:
Man sammelt im Vorfeld reichlich Speichel. Zu diesem gibt man etwa eine Spatelspitze Calciumchlorid und vermischt das Ganze gut. Davon gibt man vor 45 Minuten Versuchsbeginn circa 3 mL in zwei Demonstrationsgläser und fügt 3 mL der Magnesiumnitrat-Lösung in das eine und 3 mL der Bleinitrat-Lösung in das andere Demonstrationsreagenzglas. In das dritte Demonstrationsreagenzglas gibt man nur den Speichel mit dem Calciumchlorid. Die Stärke-Lösung wird kurz zum Sieden gebracht und stehen gelassen, bis sie abgekühlt ist. Dann gibt man ein paar Tropfen Lugolsche Lösung bis zu einer tiefblauen Färbung hinzu. Am besten wird währenddessen mit dem Glasstab umgerührt, damit man den Färbegrad besser verfolgen kann. Mittels der 10 mL Messpipette gibt man nun zu den drei vorbereiteten Demonstrationsreagenzgläsern je 10 mL der Stärke- Lugolsche-Lösung, sowie auch in das leere vierte Reagenzglas. Das Hinzufügen der Stärke- Lugolsche-Lösung in die Demonstrationsreagenzgläser sollte möglicht zeitgleich erfolgen.
(vgl. [PdN-Ch. 3/82, S. 88 f.])
Hier noch einmal zur besseren Übersicht eine tabellarische Darstellung:
Reagenzglas 1 2 3 4
Mg(NO3)2(aq) x
Pb(NO3)2(aq) x
Speichel x x x
Stärke-
Lugolsche-Lsg.
x x x x
Beobachtung:
Bei Zugabe der Lugolschen-Lösung zur Stärke entsteht eine tiefblaue Färbung. Diese bleibt im Reagenzglas 1 bestehen. Bei Zugabe des Speichels im Reagenzglas 2 beginnt sich die
Lösung relativ schnell zu entfärben. Im Reagenzglas 3 erfolgt keine Entfärbung, während im Reagenzglas Nummer 4 eine sehr langsame Entfärbung statt findet.
Auswertung:
Die Stärke ist ein pflanzliches Polysaccharid, welches aus zwei Komponenten besteht. Die Bestandteile bilden zu 70% - 90% das Amylopektin und zu 10% - 30% die Amylose. Bei beiden sind die Grundbausteine Glucose-Moleküle. Sie unterscheiden sich nur durch die Verknüpfung dieser. Die Amylose besteht aus Glucose-Molekülen, welche nur α-1,4- glycosidisch miteinander verbunden sind. Dadurch wird eine lineare Kette gebildet, welche über Wasserstoffbrückenbindungen als Sekundärstruktur eine Helix ausbildet, wie in Abbildung 8 zu sehen ist. Das Amylopektin hat zusätzlich α-1,6-glycosidische Verknüpfungen der Glucose-Moleküle (Abbildung 9), so dass sich Seitenketten an der Helix befinden. (vgl. [C. E. Mortimer, S. 587])
In der Lugolschen Lösung liegen Polyiodid-Ionen vor. Diese reagieren mit der Stärke unter Ausbildung einer Art Komplexes, in welchem sich die Polyiodid-Ionen in die Hohlräume der Stärkehelix eingelagert haben und bilden so über Charge-Transfer die intensivblaue Farbe (Absorptionsmaximum bei 620 nm), welche im Reagenzglas 1 bestehen bleibt. Exemplarisch für die Polyiodid-Ionen ist in der folgenden Reaktionsgleichung das Triiodid angegeben:
(vgl. [E. Gerstner, S. 14 f.])
Die α-Amylase spaltet, wie der Name schon sagt, die Amylose auf. Sie spaltet also in der Stärke nur die α-1,4-glycosidisch miteinander verbundenen Moleküle auf. Die kleinsten dabei entstehenden Einheiten sind Maltose-Moleküle. Maltose ist ein Disaccharid aus zwei Glucose-Molekülen, in α-1,4-glycosidischer Verknüpfung. Durch die Aufspaltung geht die Helix verloren, so dass sich die Polyiodid-Ionen nicht mehr in deren Hohlräume einlagern können. Die intensivblaue Farbe verschwindet, wie dies im Reagenzglas Nummer 2 der Fall ist. Ca2+-Ionen sind das Cosubstrat des Enzyms. Das Calciumchlorid wurde trotzdem dem Speichel extra hinzu gefügt, damit dieses noch besser wirken kann. Das pH-Wert Optimum
Abb. 8: Amylose, [N. A. Campbell, S. 74] Abb. 9: Amylopektin, [N. A. Campbell, S. 74]
mK+(aq)+ mI3-
(aq) + (C6H10O5)n(aq) mK+(aq)+ "(I3-)m……. (C6H10O5)n(aq)“
der α-Amylase liegt bei 6,9, dieses wird durch das im Speichel enthaltene Hydrogencarbonat erreicht.
Die α-Amylase ist, wie schon erwähnt, ein Enzym und diese bestehen aus Aminosäuren. Für die Auswertung der Reaktion im dritten Reagenzglas habe ich daher beispielhaft die Aminosäure Cystein verwendet. Aminosäuren wirken nach dem Schlüssel-Schloss-Prinzip, wofür sie eine spezifische Enzymkonformation besitzen müssen. Diese wird beim Cystein über die Sulfhydryl-Gruppe, durch Ausbildung von Wasserstoffbrückenbindungen, erreicht.
Wenn nun aber, wie im Reagenzglas Nummer 3, Blei-Ionen in der Lösung enthalten sind, passiert folgendes:
Die Blei-Ionen lagern sich an die Sulfhydryl-Gruppe unter Ausbildung eines Ringschlusses im Zwitterion bei hoher Konzentration der Blei-Ionen. Bei niedrigerer Konzentration der
C C C
H
H H
+H3N
SH O- O
O
+ Pb2+(aq)
C C C
H H
H S
+H3N
O O-
Pb
C C C
O O-
+H3N H H
H S
Pb
S C H
H C C H
O O-
NH3+ + 2 H+(aq)
C C C
H
H H
+H3N SH
O- O
O
+ Pb2+(aq),
+ H+(aq)
Blei-Ionen hingegen werden zwei Cystein-Moleküle überbrückt (vgl. [PdN-Ch. 3/82, S. 88 f.]). Dadurch kann nun das Enzym keine Wasserstoffbrückenbindungen über die Sulfhydryl- Gruppe mehr eingehen und die Enzymkonformation ändert sich, wodurch deren Wirkungsweise gehemmt ist. Daher kann die α-Amylase die Amylose nicht aufspalten und es findet im dritten Reagenzglas keine Entfärbung statt. Im vierten Reagenzglas, in welchem sich unter anderem das Magnesiumnitrat befindet, erfolgt, wenn auch eine etwas langsamere, Entfärbung. Dieses Reagenzglas dient zum direkten Vergleich mit Reagenzglas Nummer 3, um zu sehen, dass nicht Metall-Ionen allgemein die Reaktion der α-Amylase verhindern.
Nun gibt es aber nicht nur für Organismen schädlich wirkende Metalle, sondern auch sehr wichtige. Dies möchte ich mit dem nächsten Metall, dem Eisen zeigen, welches unter allen Elementen besonders viele Funktionen in der lebenden Umwelt einnimmt.
2.4 Rund ums Eisen - Physiologisches
Das Eisen ist ein Element der 8. Gruppe. Frauen benötigen täglich zwischen 14-28 mg an Eisen-Ionen, Männer dagegen nur etwa 5-9 mg. Nahrungsmittel wie Kakao, Kaviar, Hülsenfrüchte, Fleisch und Eier haben einen hohen Eisengehalt. Im Körper liegen 75% der Eisen-Ionen im Knochenmark vor (vgl. [A. F. Holleman, E. Wiberg, S. 1513]). In Organismen liegt das Eisen prinzipiell in Form von Eisenproteinen vor. Diese lassen sich folgendermaßen einteilen:
Hämproteine Nichthämproteine
Eisenporphinproteine Funktionen Fe-S-Proteine Funktionen Hämoglobin tier. O2-Transport Ferredoxine e--Transfer Myoglobin tier. O2-Speicherung Nitrogenasen N2-Red. zu NH3
Cytochrome e--Transport
Oxygenasen Oxygenierung mit O2
Oxydasen O2-Reduktion Fe-Proteine Funktionen
Peroxidasen Oxidation mit H2O2 Ferritine tier. Fe-Transport Katalasen H2O2-
Disproportionierung
Transferrine Fe-Speicherung
Im weiteren Verlauf wird kurz auf die Cytochrome und intensiver auf die Ferredoxine eingegangen, welche die gleiche Funktion haben, den e--Transfer. Auch die Katalase, als ein
Abb. 10: Eisenproteine ,[A. F. Holleman, E. Wiberg, S.1530]
Hämprotein, wird noch vorgestellt. Ein besonderer Augenmerk sollte auf das Transferrin gelegt werden, da der Eisentransport im Blut über den Transferrin-Eisen-Komplex erfolgt. In diesem ist das Eisen stark gebunden, woraus eine antibakterielle Wirkung resultiert, da die Bakterien Eisen für ihre Vermehrung benötigen. Transferrin kommt auch in der Muttermilch in Form des Lactotransferrins und im Ei als Ovotransferrin.
Wie auch bei den anderen Metallen, kann es bei erhöhter oder erniedrigter Eisen- Konzentration zu verschiedenen Krankheitsbildern führen. So kann eine vermehrte Eisenspeicherung im Gehirn kann zu degenerative Krankheiten, wie Parkinson oder Alzheimer begünstigen. Hämochromatase nennt man die vermehrte Speicherung in Leber, Pankreas, Milz oder Herz. Dies kann bis zu Krebserkrankungen führen. Bei einer verminderten Eisenspeicherung leidet man an Anämie, das heißt an Blutarmut. Davon gibt es viele verschiedene Formen, als Beispiel sei hier die Thalassämie genannt, die sogenannte Mittelmeeranämie. Bei dieser wird die Globinsynthese gehemmt. Allgemein leidet man bei einer zu geringen Eisenkonzentration an einem geschwächten Immunsystem. (vgl. [J. Emsley, S. 49])
Mit dem folgenden dritten Versuch möchte ich eine, zuvor kurz erwähnte, Funktion des Eisens als Elektronenüberträger zeigen.
2.4.1 Versuch 3: Atmungskette
Die Atmungskette ist der 3. Stoffwechselprozess, nach der Glycolyse und dem Citratcyclus, um Energie in Form von ATP zu gewinnen. Dazu wurden in der Glycolyse H-Atome von der Glucose abgespalten. Je ein H-Atom und zwei Elektronen werden von NAD+ und FAD+ aufgenommen,, welche zu den Reduktionsäquivalenten NADH und FADH2 reagieren. Die Atmungskette besteht aus vier Enzymkomplexen, welche sich in der inneren Mitochondrienmembran befinden:
Die Reduktionsäquivalente NADH und FADH2 übertragen die Elektronen an die Komplexe der Atmungskette, NADH an den ersten Komplex, welcher aus einem Flavomononucleotid und einem Eisen-Schwefel-Cluster gebildet wird und FADH2 an den Komplex II, welcher ein reines Eisen-Schwefel-Protein ist. Die Elektronenübertragung erfolgt dabei kaskadenartig.
Diese Komplexe übertragen die Elektronen an Ubichinon, welches als einziges ein Lipid und somit kein Protein ist. In den Komplexen III und IV befinden sich die in der Abbildung 10 aufgeführten Cytochrome, welche auch die Elektronen weitergeben. Als letztes Enzym überträgt das Cytochrom a3 Elektronen an Sauerstoff. (vgl. [N. A. Cambell, S. 187])
Das reine Eisen-Schwefel-Protein (Komplex II) gehört zu einer Familie, welche direkt an Aminosäuren gebunden sind. Es ist ein [4Fe-4S]-Cluster mit einer verzerrt würfelartigen Struktur. Dabei ist jedes Eisenatom mit je einem Cysteinatrest des Proteins koordiniert:
Chemikalien:
- Cystein, m = 0,5 g
- FeSO4 • 7H2O, m = 0,3 g
- CH3COONa, V = 100 mL, c = 0,5 mol/L
Abb. 11: Atmungskette, [N. A. Cambell, 2001, S. 187]
SCyst
Fe
Abb. 12: [4Fe-4S]-Cluster, [Prof. Dr. M. Bröring, 2006/2007, Bioanorganische Chemie II- Stunde 2, S. 5; Änderung durch die Vf.]
Gefahrensymbole/R- und S-Sätze:
Chemikalie R-Sätze S-Sätze Gefahrensymbol
Cystein
FeSO4 • 7H2O 22 24/25 Xn
CH3COONa Materialien:
- 300 mL Erlenmeyerkolben mit passendem Stopfen
- Waage, Spatel
- kleines Becherglas Durchführung:
Man gibt in den Erlenmeyerkolben das Cystein, fügt 100 mL Natriumacetat-Lösung hinzu und schüttelt dies gut. Dann gibt man das Eisen(II)-Sulfat dazu und schüttelt erneut gut durch.
Nun lässt man das Reaktionsgemisch eine Weile stehen und beobachtet was passiert. Dann kann erneut geschüttelt werden. (vgl. [P. Schopfer, S.131])
Beobachtung:
Nach kurzer Zeit des Schüttelns (nach Zugabe des Eisen(II)-Sulfats) entsteht eine blauviolette Farbe. Diese verschwindet, wenn das Reaktionsgemisch längere Zeit stehen gelassen wird.
Bei erneutem Schütteln entsteht wieder eine Färbung.
Auswertung:
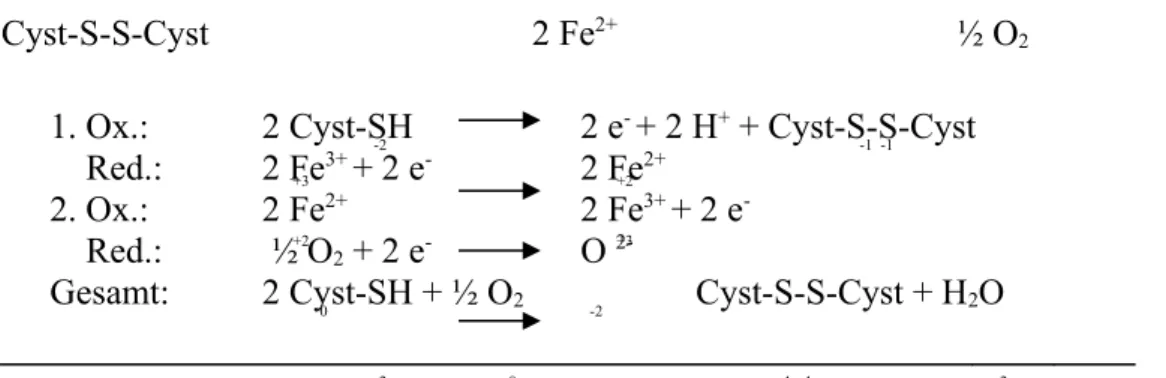
Das Fe2+ aus dem Eisen(II)-sulfat dient hier als Katalysator. Es reagiert zunächst als Reduktionsmittel mit dem Luftsauerstoff, welcher zum Oxygenium-Ion reduziert wird. Das Eisen-Ion liegt nun in oxidierter Form als Fe3+ vor. Das Cystein reagiert unter Oxidation zu dem Dimer Cystin, unter Ausbildung einer Disulfidbrücke. Die dabei abgegeben Elektronen reduzieren die Fe3+-Ionen nun wieder zu Fe2+-Ionen, sie liegen nun im Ausgangszustand vor.
Das Oxygenium-Ion reagiert mit den zwei Protonen, welche vom Cystein abgegeben wurden, zu Wasser:
2 H+ H2O
2 Cyst-SH 2 Fe3+ O2-
Cyst-S-S-Cyst 2 Fe2+ ½ O2
Die Reaktion kann dabei gut experimentell verfolgt werden, da die Fe3+-Ionen mit dem Cystein einen Komplex bilden, worauf die blauviolette Färbung beruht. Da die fünf Elektronen im Fe3+ im high spin-Zustand vorliegen, kann die Farbe nur auf Charge-Transfer beruhen, da hier die d-d-Übergänge verboten sind.
In diesem Chelatkomplex ist das Fe3+ als Zentralatom von zwei Cystein-Molekülen oktaedrisch umgeben.
Sobald der Sauerstoff in der Lösung verbraucht ist, liegt das Eisen-Ion als Fe2+ vor, welches mit dem Cystein einen farblosen Komplex bildet.
dyz
dxz
dxy
dz2
dx2-y2
-1 -1 0
-2
-2 0
+3 +2
+2 +3
-1 -1
1. Ox.: 2 Cyst-SH -2 2 e- + 2 H+ + Cyst-S-S-Cyst Red.: 2 Fe3+ + 2 e- 2 Fe2+
2. Ox.: 2 Fe2+ 2 Fe3+ + 2 e- Red.: ½ O2 + 2 e- O 2-
Gesamt: 2 Cyst-SH + ½ O2 Cyst-S-S-Cyst + H2O
-2
eg
t2g
Abb. 13: Besetzung der fünf d-Orbitale mit fünf Elektronen im high-spin Fall
Abb. 14: Oktaedrischer Chelatkomplex, [C. Sondergeld, S. 17]
In der Abbildung 10 war zu sehen, dass Eisen auch andere Funktionen, als die des Elektronenüberträgers, besitzt. Der Beweis kann mit dem folgenden Versuch gemacht werden.
2.4.2 Versuch 4: Enzymatische Wirkung der Katalase
Die Katalase ist ein Hämprotein. Sie kommt in den Peroxisomen vor. Die Peroxisomen haben ihren Namen durch Wasserstoffperoxid erhalten, welches als Zellgift in den Peroxisomen entsteht. Dies geschieht dadurch, dass Wasserstoff von unterschiedlichen Substanzen abgespalten wird und mit molekularem Sauerstoff zu Wasserstoffperoxid reagiert.
Peroxisomen dienen zum Beispiel in der Leber zum Alkoholabbau (vgl. [N. A. Campbell, S.
137]). Die Katalase sieht wie folgt aus:
Man kann auch hier die α-Helices und β-Faltblätter erkennen, welche über Schleifen miteinander verbunden sind. In der Mitte ist das Porphyrinringsystem rot gekennzeichnet mit dem Eisen(III)-Ion als Zentralatom (grau).
Chemikalien:
- etwa 300 mL Schweineblut (vom Schlachthof)
- 3% H2O2 (ein paar Tropfen)
- Citrat oder Citronensäure Gefahrensymbole/R- und S-Sätze:
Chemikalie R-Sätze S-Sätze Gefahrensymbol
Blut
H2O2, 3%ig Citrat
Abb. 15: Katalase, [www.biokurs.de/skripten/bilder/catalas1.gif]
Materialien:
- unskalierter Standzylinder (möglichst geringer Durchmesser)
- Spatel
- Pipette Durchführung:
Dem Blut werden, nach dem Abholen im Schlachthof, gleich ein-zwei Spatelspitzen Citrat bei gefügt, dann ist es bis zu 48 Stunden, bei Lagerung im Kühlschrank, verwendbar. Man füllt nun in etwa 3-5 cm Blut in den Standzylinder und tropft ein paar Tropfen des Wasserstoffperoxids dazu.
Beobachtung:
Sofort nach Zugabe des Wasserstoffperoxid steigt bzw. „schießt“ eine weiße locker schaumige Masse empor.
Auswertung:
Das Blut ist durch Zugabe des Citrats länger verwendbar, da durch Komplexierung der Calcium-Ionen die Blutgerinnung verhindert wird:
Ca2+(aq) + 2 CitH3(s) [Ca(Cit)2]4-(aq) + 6 H+(aq)
Dabei wird ein oktaedrischer Chelatkomplex ausgebildet, der Dicitratocalcium-Komplex.
Die Reaktion ist eine enzymatisch katalysierte Disproportionierung, daher erfolgt die Reaktion sehr schnell. Das Wasserstoffperoxid, welches das Zellgift demonstrieren soll, reagiert, unter der katalytischen Einwirkung der Katalase, zu Wasser und Sauerstoff. Durch den freigesetzten gasförmigen Sauerstoff schäumt das Blut stark auf.
2 H2O2(aq) 2 H2O + O2(g)
Der Sauerstoff im Wasserstoffperoxid wird einmal reduziert von der Oxidationszahl –1 zu –2 im Wasser-Molekül und einmal oxidiert von der Oxidationszahl –1 zur Oxidationszahl 0 im elementarem Sauerstoff.
<Katalase>
Red OX
+1 -1 +1 -2 0
Wir haben gesehen, dass die Katalase zu den Hämproteinen mit dem Porphyrinringsystem gehört. In der linken Abbildung ist die Häm-Gruppe zu sehen:
Das Ringsystem kann jedoch auch andere Metall-Ionen komplexieren, wie in der rechten Abbildung, dem Chlorophyll zu sehen ist. Wenn dieses als Rest eine Aldehyd-Gruppe trägt, dann ist es Chlorophyll b und bei einer Methyl-Gruppe das Chlorophyll a.
Kurz erwähnen möchte ich hierbei, dass die Chromophore Hämerythrin und Hämocyanin keine, wie der Name eigentlich vermuten lässt, Häm-Gruppe besitzen. Diese Blutfarbstoffe besitzen zum Beispiel Molluscen (Weichtiere) und Arthropoden (Gliederfüßer).
2.5 Rund ums Magnesium - Physiologisches
Das Magnesium ist ein Erdalkalimetall, also Element der 2. Gruppe. Der Tagesbedarf liegt bei rund 200 mg, überschüssiges wirkt abführend. Diese Wirkung des Magnesiums wird in einigen Abführsalzen, wie dem Schüssler-Salz Magnesiumhydrogenphosphat oder dem Bittersalz Magnesiumsulfat zu Nutze gezogen. Die Hauptnahrungsquellen für Magnesium sind Getreide und grünes Blattgemüse. Die Magnesium-Ionen haben mehrere verschiedene Funktionen in Organismen, dazu zählt, dass es ein Baustein von unterschiedlichen Enzymen ist, es reguliert den Stofftransport durch Membranen und es ist, wie bereits erörtert, das Zentralatom im Chlorophyll. Bei einem Magnesiummangel bei Pflanzen kommt es zur sogenannten Chlorose (Blattvergilbung durch Chlorophyllmangel). (vgl. [A. F. Holleman, E.
Wiberg, S. 1116])
Abb. 16: Häm,
[www.chemgapedia.de/vsengine/media/vsc
/de/ch/16/oc/geos_gifs/porphyrin.gif] Abb. 17: Chlorophyll,
[www.adeviq-spin.com/chloroph.gif]
Phytyl
2.5.1 Versuch 5: Magnesiumnachweis Chemikalien:
- Chlorophyllrohextrakt Spinat, Seesand(aq), Methanol(aq), Ca2CO3(s) - HCl(aq), c = 2 mol/L
- NaOH(aq), c = 2 mol/L
- 0,05 % Titangelb
Gefahrensymbole/R- und S-Sätze:
Chemikalie R-Sätze S-Sätze Gefahrensymbol
Methanol 11-23/24/25-
39/23/24/25
7-16-36/37-45 T, F Ca2CO3
HCl(aq), c = 2 mol/L
NaOH(aq), c = 2 mol/L 35 26-36/37/39-45 C
Titangelb, 0,05%ig Materialien:
- Mörser und Pistill
- Waage, Indikatorpapier
- 2 kleine Bechergläser
- 50 mL Messzylinder
- Faltenfilter, Trichter
- Erlenmeyerkolben
- Reagenzglas, Reagenzglasklammer
- Bunsenbrenner
- 3 Pipetten
- Petrischale, Overheadprojektor Durchführung:
Herstellung des Rohextraktes:
Es werden in etwa 5 g Spinat abgewogen und in den Mörser gefüllt. Nun wiegt man in einem Becherglas 5 g Seesand und in dem anderen Becherglas 1 g Calciumcarbonat ab und gibt diese auch in den Mörser. Mit dem Messzylinder werden 30 mL Methanol abgemessen und
in den Mörser gefüllt. Nun wird das Ganze mit dem Pistill fein zerrieben. Die so erhaltene Rohchlorophylllösung wird mittels dem Trichter und einem Faltenfilter in den Erlenmeyerkolben abfiltriert.
Nachweis des Magnesiums:
Man füllt etwa 2 cm des Reagenzglases mit dem Chlorophyllrohextrakt. Dazu gibt man solange Salzsäure, bis der Extrakt angesäuert ist. Dies erwärmt man nun kurz in der Bunsenbrennerflamme. Danach macht man die Lösung leicht alkalisch und gibt es in die Petrischale. Diese wird auf den Overheadprojektor gestellt und dort mit ein paar Tropfen Titangelb versehen.
Beobachtung:
Bei dem Zutropfen des Titangelbs bildet sich, im zuvor hellgrünen Reaktionsgemisch, ein hellroter Niederschlag.
Auswertung:
Bei der Herstellung des Rohextraktes dient der Seesand der mechanischen Zerkleinerung des Spinats, das Calciumcarbonat neutralisiert den sauren Zellsaft und das Methanol ist das Lösungsmittel für das Chlorophyll.
Die dem Rohextrakt zugegebene Salzsäure löst das Zentralatom im Chlorophyll, das Mg2+- Ion, heraus und protoniert das Porphyrinringsystem zum sogenannten Phaeophytin:
Die freien Magnesium-Ionen können nun in der alkalischen Lösung nachgewiesen werden:
Mg
H+
Mg2+ +
Abb. 18: Phaeophytin,
[www.ch.tum.de/oc1/History/Chlorophyllsynthesis/image197.gif]
Dabei entsteht ein hellroter Farblack. Wie der entstandene Komplex aussieht, weis man heute noch nicht genau. Vermutlich wird das Magnesium-Ion von zwei Molekülen Titangelb komplexiert. Dies würde über die freien Elektronenpaare der Stickstoff-Atome, welche als Chelatliganden fungieren, erfolgen.
Mit der zweiten Demonstration soll gezeigt werden, dass nach Zugabe der Salzsäure zum Chlorophyllrohextrakt und kurzem Erhitzen dessen, dieses nicht mehr in seinem Ausgangszustand vorliegt.
2.5.2 Demonstration 2: Dünnschichtchromatographie Chemikalien:
- Petroleumbenzin
- Isopropanol
- Dest. Wasser
- Kieselgelplatte
- Methanol
Gefahrensymbole/R- und S-Sätze:
Chemikalie R-Sätze S-Sätze Gefahrensymbol
Methanol 11-23/24/25-
39/23/24/25
7-16-36/37-45 T, F Petroleumbenzin 11-38-65-67-51/53 9-16-29-33-60-61 F, Xn, N
Isopropanol 11-36-67 7-16-24/25-26 F, Xi
Materialien:
- DC-Kammer
- Bunsenbrenner
- 2 Pipetten
H3C
N C S
SO3Na
N
N N
H SO3Na
CH3 N
S C
Mg2+ + hellroter
NS
- Kapillaren
- Bleistift und Lineal
- Reagenzglas
- Reagenzglasklammer
- Messzylinder Durchführung:
Herstellung des Fließmittels:
Mittels des Messzylinders wird das Fließmittelgemisch in folgendem Verhältnis dargestellt:
Petroleumbenzin 10 : Isopropanol 1: dest. Wasser 0,25. (vgl. [Skriptum PPK, S. 29]) Herstellen der Dünnschichtchromatographie:
Man trägt ca. 1 cm vom unteren Ende der Kieselgelplatte mit Bleistift und Lineal eine Linie auf. Einen Zentimeter vom linken Rand trägt man mit der Kapillare einen Tropfen des Chlorophyllrohextraktes auf und lässt diesen trocknen. Dabei soll darauf geachtet werden, dass dieser nicht allzu weit ausläuft. Danach wiederholt man den Vorgang noch zweimal.
Einen Zentimeter vom rechten Rand trägt man das erhaltene Produkt des Chlorophylls nach Ansäuerung auf, jedoch muss dieses zunächst im Reagenzglas in der Bunsenbrennerflamme verdampft werden. Dann wird es mit ein wenig Methanol (gerade soviel, dass mit der Kapillare drei Tropfen auf die Kieselgelplatte aufgebracht werden können) wieder aufgenommen. Dies muss gemacht werden, da die Substanzflecken sonst nicht im Fließmittel löslich sind und deshalb nicht mitlaufen. Wenn dies geschehen ist, bringt man die drei Tropfen mittels Kapillare auf die Kieselgelplatte auf. Dann kann diese in die DC-Kammer, in welcher sich weniger als 1 cm des Fließmittels befindet, gestellt werden. Wenn das Fließmittel bis ca. 1 cm unter den oberen Rand gelaufen ist, wird sie aus der Kammer heraus genommen und getrocknet. Man markiert die Substanzen, da diese mit der Zeit verblassen.
Dann kann der Retentionsfaktor berechnet werden.
Auswertung:
Das Fließmittel bildet die sogenannte mobile Phase, sie wird durch Kapillarkräfte an der DC- Karte empor gesogen und nimmt die Substanzen entsprechend ihrer Zusammensetzung weit mit. Die DC-Karte ist in diesem Fall eine Kieselgelplatte, diese bildet die stationäre Phase. An
ihr bleiben die im Fließmittel gelösten Stoffe mehr oder weniger haften (=Retention). Bei diesem fast gänzlich unpolaren Fließmittel werden unpolare Substanzen weiter mit genommen, da: „similiar similibus solvuntur“. Dies entspricht auch der Realität, so sind die gänzlich unpolaren Carotine, welche reine Kohlenwasserstoffe sind, am weitesten geflossen.
Das Phaeophytin ist weiter vom Fließmittel mitgenommen worden, da es durch Herauslösen des Magnesium-Ions an unpolarem Charakter zugenommen hat. Chlorophyll a ist weiter gelaufen, als Chlorophyll b, was an dem unterschiedlichen Rest liegt, welcher bei Chl a eine unpolare Methyl-Gruppe ist und bei Chl b eine polare Aldehyd-Gruppe. Unter dem Chlorophyll liegen die Xanthophylle, welche polare Sauerstoffgruppen tragen:
Nun kann der Retentionsfaktor berechnet werden, er ergibt sich aus der Division der Laufstrecke der Substanz durch die Laufstrecke der Fließmittelfront:
Laufstrecke Substanz Laufstrecke Fließmittelfront
Typische Werte für diese stationäre und mobile Phase sind: Carotine = 0,82, Chlorophyll a = 0,61, Chlorophyll b = 0,45.
3. Schulrelevanz
Laut hessischem Lehrplan für den gymnasialen Bildungsgang (G 9) im Fach Chemie soll in der 8. Klasse in das Thema „Chromatographie“ eingeführt werden. In dieser Klassenstufe kann man die Dünnschichtchromatographie schon kurz vorstellen und eine bereits angefertigte zeigen. Näher wird auf dieses Thema in der Klassenstufe 13/2 eingegangen, dort
Abb. 19: DC von Chlorophyll und Phaeophytin
Carotine
Phaeophytin Chlorophyll a Chlorophyll b Xanthophylle
Rf =
könnten die Schüler selbst eine Dünnschichtchromatographie durchführen. In der 10. Klasse wird der Aufbau und die Funktion von Böden besprochen. Zu diesem Zeitpunkt könnte ein Versuch ähnlich der ersten Demonstration gemacht werden, um zu zeigen, wie notwendig Metall-Ionen für den Boden und Pflanzen sind. In der 12/2 werden technisch und biologisch wichtige Kohlenstoffverbindungen behandelt. In dieser Klassenstufe wird dann auch näher auf Enzyme und ihren Aufbau, sowie ihre Bedeutung in Stoffwechselprozessen eingegangen.
Zu diesem Thema könnten die Wirkung der α-Amylase und der Versuch 4, die enzymatische Wirkung der Katalase demonstriert werden. Außerdem wird in diesem Jahrgang die Photosynthese und die Zellatmung im Fach Chemie besprochen, zur Zellatmung kann das Experiment „Atmungskette“ durchgeführt werden.
Zu diesem Experimentalvortragsthema kann sehr gut fächerübergreifend mit dem Fach Biologie gearbeitet werden. Im zweiten Halbjahr der Klasse 7 wird die Bedeutung der Photosynthese für das Leben auf der Erde und unsere Ernährung behandelt, wozu Nachweisreaktionen, zum Beispiel zu Stärke, gemacht werden. In der 9. Klasse wird auf die Blutgerinnung und die Sauerstoffbindung an Hämoglobin eingegangen. Dabei könnte gezeigt werden, wie wichtig Ca2+ für die Blutgerinnung ist, indem man Blut einmal mit und einmal ohne Citrat zur Ca2+-Komplexierung, ein paar Tage stehen lässt. Auch im Fach Biologie wird in 12/2 über die Photosynthese und die Zellatmung gesprochen, so dass sich hier die Zusammenarbeit mit dem Fach Chemie besonders lohnen würde.
4. Abschlussbetrachtung
Natürlich konnte in diesem Rahmen nur ein kurzer Einblick in das Thema gegeben werden.
Ich hoffe jedoch, dass dabei deutlich geworden ist, wie wichtig Metalle für Lebewesen sind und dass es vor allem auch auf die zugeführte Menge ankommt, denn wie Paracelsus (eigentlicher Name: Theophrastus Bombastus von Hohenheim, 1493-1541) 1537 schon sagte:
(zit. n. [www.mdr.de/hauptsache-gesund/874661-hintergrund-868598.html - 32k -])
Was passieren kann, wenn man an einem Calciummangel leidet, zeigt abschließend die letzte Abbildung:
Literaturverzeichnis:
Lehrbücher:
Bröring, Martin: Bioanorganische Chemie I, Stunde 4. Fachbereich Chemie, Philipps- Universität Marburg, 2006/2007
Abb. 20: Paracelsus,
[www.bad-bad.de/gesch/paracl.gif]
„Was ist das nit gifft ist?
Alle ding sind gifft/ und nichts ohn gifft/
allein die dosis macht das ein ding kein gifft ist.
Als ein Exempel ein jetliche speiss und ein jetlich getranck so es uber sein dosin eingenommen wirdt so ist es gifft, das beweist sein aussgang.
Ich geb auch zu, das gifft, gifft sey.“
Abb.21: Folgen eines Nährstoffmangels
[www.esche-world.de/images/rsgallery/thumb/schlecht_zaehne.jpg.jpg]
Campbell, Neil A.: Biologie. Spektrum Akademischer Verlag GmbH Heidelberg, Berlin, Oxford, 2000
Emsley, John: Sonne, Sex und Schokolade – Mehr Chemie im Alltag. Wiley-VCH Verlag GmbH & Co. KgaA, Weinheim, 2006
Gerstner, E.: Skriptum Versuche zur Chemie der Nichtmetalle auf der Basis von E. Fluck/ C.
Mahr, Anorganisches Grundpraktikum, Weinheim, 1985
Holleman, Arnold F., Wiberg, Nils: Lehrbuch der anorganischen Chemie. 101. Auflage, Walter de Gruyter, Berlin · New York, 1995
Kaim, Wolfgang, Schwederski, Brigitte: Bioanorganische Chemie - Zur Funktion chemischer Elemente in Lebensprozessen. 4. Auflage, B. G. Teubner Verlag/ GWV Fachverlage GmbH, Wiesbaden, 2005
Lehrplan Chemie, Gymnasialer Bildungsgang, Jahrgangsstufen 8–13, Hessisches Kultusministerium
Mortimer, Charles E.: Chemie – Das Basiswissen der Chemie. 7. Auflage, Georg Thieme Verlag, Stuttgart·New York, 2001
Schopfer, P.: Experimentelle Pflanzenphysiologie – Einführung in die Anwendung. Band 2, Springer Verlag, Berlin, 1989
Skriptum zum Pflanzenbiologischen Kurs für Diplomstudierende im Grundstudium und L3- Studierende im Hauptstudium, Fachbereich Biologie, Philipps-Universität Marburg, 2005/2006
Sondergeld, Carmen: Metalle in Lebewesen – Ein Einblick in die bioanorganische Chemie, Experimentalvortrag. 2003
Sundermeyer, J.: Zersetzung von H2O2 durch organische Stoffe (Katalasen, Fermente) und Vergiftung des Katalysators. Arbeitsblatt, Versuch Nr:8/17
Zeitschriften:
Herr, Ferdinand: Blei als umweltbelastender Faktor und seine chemisch-biochemische Wirkung – Ein Beispiel für eine mögliche Unterrichtsreihe. Praxis der Naturwissenschaften, 3/82, 84-90
Internet:
www.adeviq-spin.com/chloroph.gif www.bad-bad.de/gesch/paracl.gif www.beethoven-france.org
www.biokurs.de/skripten/bilder/catalas1.gif
www.chemgapedia.de/vsengine/media/vsc/de/ch/16/oc/geos_gifs/porphyrin.gif www.ch.tum.de/oc1/History/Chlorophyllsynthesis/image197.gif
www.3sat.de/nano/news/11258/index.html
www.esche-world.de/images/rsgallery/thumb/schlecht_zaehne.jpg.jpg www.experimentalchemie.de/05-e-pse.htm
www.zum.de/Faecher/Materialien/beck/bilder/amlase.gif


![Abb. 4: Die 14 für den Menschen essentiellen Metalle, (vgl. [J. Emsley, S.34]; Hervorhebung durch die Vf.)](https://thumb-eu.123doks.com/thumbv2/1library_info/3938582.1532849/5.892.130.793.478.631/abb-menschen-essentiellen-metalle-vgl-emsley-hervorhebung-vf.webp)
![Abb. 6: Ludwig van Beethoven, [www.beethoven-france.org]](https://thumb-eu.123doks.com/thumbv2/1library_info/3938582.1532849/11.892.107.222.562.703/abb-ludwig-van-beethoven-www-beethoven-france-org.webp)
![Abb. 7: α-Amylase , [www. zum.de/Faecher/Materialien/beck/bilder/amlase.gif]](https://thumb-eu.123doks.com/thumbv2/1library_info/3938582.1532849/12.892.106.296.212.384/abb-amylase-www-faecher-materialien-beck-bilder-amlase.webp)
![Abb. 10: Eisenproteine , [A. F. Holleman, E. Wiberg, S.1530]](https://thumb-eu.123doks.com/thumbv2/1library_info/3938582.1532849/16.892.104.795.819.1045/abb-eisenproteine-f-holleman-e-wiberg-s.webp)
![Abb. 15: Katalase , [www.biokurs.de/skripten/bilder/catalas1.gif]](https://thumb-eu.123doks.com/thumbv2/1library_info/3938582.1532849/21.892.107.406.588.793/abb-katalase-www-biokurs-skripten-bilder-catalas-gif.webp)

