Versuch 07
Der Adiabatenexponent
Sommersemester 2005
Name: Daniel Scholz
Mitarbeiter: Hauke Rohmeyer
EMail: physik@mehr-davon.de
Gruppe: 13
Assistent: Dagmar Steinhauser Durchgef¨ uhrt am: 07. Juli 2005
Protokoll abgebeben: 14. Juli 2005 Protokoll verbessert: —
Unterschrift:
Testiert:
1 Einleitung
In diesem Versuch soll der Adiabatenexponent κ = c p /c V nach zwei ver- schiedenen Methoden bestimmt werden. Im ersten Teil wird der Adiaba- tenexponent nach R¨ uchardt f¨ ur Luft, Argon und Kohlenstoffdioxid be- rechnet, im zweiten Teil nach Clement-Desormes f¨ ur Luft. Der Adia- batenexponent ist eine wichtige Gr¨ oße bei der Beschreibung adiabatischer Zustands¨ anderungen, insbesondere bei Gasen.
2 Theorie
2.1 Der Adiabatenexponent
Der Adiabatenexponent κ ist definiert als Quotient der spezifischen W¨ arme- kapazit¨ at bei konstantem Druck und bei konstantem Volumen.
κ := c p c V
Warum er Exponent genannt wird macht die Poisson-Gleichung deutlich, in der die Proportionalit¨ at p ∼ V −κ beschrieben wird.
2.2 Zustands¨ anderungen
Findet bei einer Zustands¨ anderung eines Gases kein W¨ armeaustausch mit der Umgebung statt, ist also ∆Q = 0, so nennt man diese Zustands¨ ande- rung adiabatisch. Ist dagegen die Temperatur konstant [∆T = 0], so nennt man sie isotherm. Ist das Volumen konstant [∆V = 0], so nennt man sie isochor. Ist schließlich der Druck konstant [∆p = 0], so nennt man sie isobar.
2.3 Poisson-Gleichung
Bei einem konstanten Gasvolumen wird keine Volumenarbeit an ihm ver- richtet. Es gilt also dW = 0. Nach dem 1. Hauptsatz der Thermodynamik folgt
dU = dW + dQ = dQ.
F¨ ur die spezifische W¨ armekapazit¨ at folgt dann c V =
dQ dT
V
= dU
dT ⇔ c V dT = dU.
Bei einem adiabatischen Prozess gilt dagegen dQ = 0. Nach dem 1. Haupt- satz folgt also
dU = dW + dQ = dW = − pdV.
Da die innere Energie dU eine Zustandsgr¨ oße ist, lassen sich die gewonnen Gleichungen nun gleichsetzten.
c V dT = dU = − pdV.
F¨ ur ein Mol [n = 1] gilt nach der idealen Gasgleichung p = RT /V . Setzt man dies ein und f¨ uhrt eine Trennung der Variablen durch folgt
c V dT = − pdV = − RT
V dV ⇔ c V
dT
T = − R dV V . Integriert man diese Gleichung auf beiden Seiten, so erh¨ alt man
c V ln T = − R ln V + C.
Wobei C eine Konstante ist. Stellt man dies nach C um, so gilt
C = c V ln T + R ln V = ln T c
V+ ln V R = ln(T c
V· V R ) = const.
Woraus schließlich
T c
VV R = const
folgt. Nun gilt c p = c V + R [siehe dazu Versuch 06: Spezifische W¨ arme der Luft und Gasthermometer], woraus R = c p − c V folgt. Somit gilt also T c
VV R = T c
VV c
p−c
V= const ⇒ T V
cp−cV
cV
= T V κ−1 = const.
F¨ ur ein Mol gilt nach der idealen Gasgleichung T = pV /R. Setzt man dies ein, so erh¨ alt man
T V κ−1 = pV κ
R = const.
Daraus folgt schließlich die Poisson-Gleichung f¨ ur ideale Gase:
pV κ = const ⇔ p ∼ V −κ .
2.4 Berechnung des Adiabatenexponentes ¨ uber die Freiheitsgrade In Versuch 06 [Spezifische W¨ arme der Luft und Gasthermometer] haben wir folgende Beziehungen hergeleitet:
c V R = f
2 ⇔ c V = f
2 R sowie
c p = c V + R = f
2 + 1
R =
f + 2 2
R.
Daraus folgt
κ = c p c V
=
f +2 2 R
f
2 R = f + 2
f .
2.5 Berechnung des Adiabatenexponentes nach R¨ uchardt
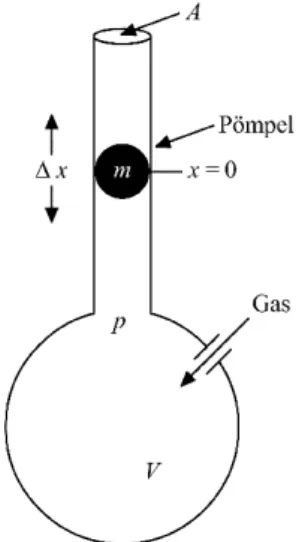
Abbildung 1: Schema des Versuchsaufbaus
In ein Gef¨ aß des Volumens V wird ein Gas gepumpt, so dass in dem Gef¨ aß der Druck p herrscht. Auf der Oberseite des Gef¨ aßes ist eine R¨ ohre mit der Querschnittsfl¨ ache A angebracht. An dem Punkt x = 0 hat die R¨ ohre ein kleines Loch. Befindet sich nun ein eng anliegender P¨ ompel in der Glasr¨ ohre [kein Gas kann an ihm vorbeistr¨ omen], so f¨ uhrt dieser eine unged¨ ampfte Schwingung aus. Befindet sich der P¨ ompel der Masse m unterhalb des Lo- ches, so dr¨ uckt ihn der ¨ Uberdruck in der R¨ ohre nach oben, hat er das Loch passiert, so kann ihn das Gas nicht weiter nach oben dr¨ ucken, da es aus dem Loch herausstr¨ omt. Nun f¨ allt der P¨ ompel aufgrund seiner Gewichtskraft mg wieder nach unten. Aus der Schwingungsdauer T l¨ asst sich κ bestimmen.
Abbildung 2: Gleichgewichtslage des P¨ ompels
Herrscht außerhalb des Gef¨ aßes der Luftdruck b, so ist der P¨ ompel im Gleich- gewicht, also wenn
mg + b · A = p · A ⇔ p = b + mg
A
gilt. Schwingt der P¨ ompel nun um ∆x ¨ uber die Gleichgewichtslage hinaus, so erh¨ oht sich der Gasdruck p im Gef¨ aß um dp. Es gilt
m¨ x = A · dp .
Um dp zu berechnen benutzt man die Poisson-Gleichung [siehe 2.3]. Es gilt also pV κ = const. Dies leitet man nun nach V ab:
d(pV κ ) = dp · V κ + p · κV κ−1 · dV = 0 V κ dp = −κV κ−1 pdV
dp = −κp dV
V = − κp A ∆x V .
Somit ergibt sich eine Differentialgleichung f¨ ur die Schwingung des P¨ ompels:
m¨ x = A · dp = − κp A 2 x
V ⇔ m¨ x + κpA 2
V x = 0.
F¨ ur diese allgemeine Schwingungsgleichung ist die L¨ osung f¨ ur die Schwin- gungsdauer
T = 2π s
mV κpA 2 .
Stellt man dies nach κ um, ergibt sich κ = 4π 2 mV
pA 2 T 2 .
Nun schwingt die Luft in dem Rohr ebenfalls mit, also ist die Masse m ef f = m + m L . Die Querschnittsfl¨ ache des Rohres ist A = πr 2 = π d 4
2.
Somit erh¨ alt man die Formel, die in der Auswertung ben¨ otigt wird:
κ = 64m ef f V
pd 4 T 2 .
2.6 Berechnung des Adiabatenexponent nach Clement-Desormes Diese Methode nutzt die Druckmessung vor und nach einer adiabatisch ab- laufenden Expansion. In einem Beh¨ alter wird der Druck mit Hilfe eines Bla- sebalges erh¨ oht. Nach einem Temperaturausgleich mit der Umgebungstem- peratur wird der Druck gemessen [Zustand 1]. Nun wird das Gas ¨ uber ein Ventil expandiert [Zustand 2]. Jetzt wird das Ventil geschlossen und man hat man wieder das Ausgangsvolumen bei einer geringeren Temperatur [Zu- stand 2]. Nach einem Temperaturausgleich wird wieder der Druck gemessen [Zustand 4].
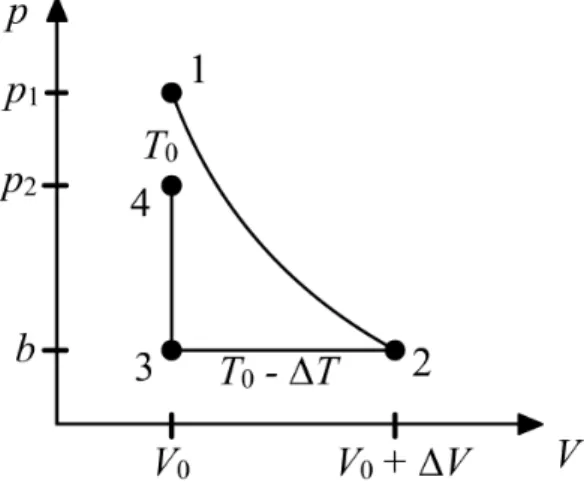
Abbildung 3: pV Diagramm des Versuchs Zustand Druck Volumen Temperatur
1 b + ∆p
1V
0T
02 b V
0+ ∆V T
0− ∆T
3 b V
0T
0− ∆T
4 b + ∆p
2V
0T
0Der ¨ Ubergang von Zustand 1 zu Zustand 2 ist adiabatisch. Somit l¨ asst sich die Poisson-Gleichung pV κ = const anwenden.
p 1 V 1 κ = p 2 V 2 κ
(b + ∆p 1 )V 0 κ = b(V 0 + ∆V ) κ .
Teilt man beide Seiten der Gleichung durch b und benutzt die f¨ ur ∆V V 0 geltende N¨ aherung (V 0 + ∆V ) κ ≈ V 0 κ + κV 0 κ−1 ∆V , folgt
b + ∆p 1
b V 0 κ = V 0 κ + κV 0 κ−1 ∆V
1 + ∆p 1
b ≈ 1 + κ ∆V V
∆p 1
b ≈ κ ∆V V
∆p 1
κ b ≈ ∆V V .
F¨ ur die Temperaturen der Zust¨ ande 1 und 2 l¨ asst sich die Poisson-Gleichung T V κ−1 = const anwenden.
T 1 V 1 κ−1 = T 2 V 2 κ−1 . Eingesetzt ergibt sich
(T 0 − ∆T )(V 0 + ∆V ) κ−1 = T 0 V 0 κ−1 ⇔ ∆T
T 0 = (κ − 1) ∆V V 0 . Setzt man ∆V /V aus der ersten Gleichung ein, folgt
∆T T 0
= (κ − 1) ∆p 1
κ b .
Da sich beim ¨ Ubergang zwischen Zustand 3 und 4 das Volumen nicht ¨ andert, kann man die Volumina gleichsetzten. F¨ ur ideale Gase gilt V = nRT /p.
V 3 = V 4
nR(T 0 − ∆T )
b = nRT 0
b + ∆p 2
. Daraus folgt
b b + ∆p 2
= T 0 − ∆T T 0
= 1 − ∆T T 0
.
Setzt man nun das oben hergeleitete Ergebnis f¨ ur ∆T /T 0 ein und formt nach κ um, erh¨ alt man schließlich
κ = b∆p 1 + ∆p 1 ∆p 2
b(∆p 1 − ∆p 2 ) + ∆p 1 ∆p 2
,
was sich f¨ ur ∆p 1 ∆p 2 b vereinfachen l¨ asst zu κ ≈ ∆p 1
∆p 1 − ∆p 2 .
Da nun f¨ ur die Druck¨ anderung im Manometer ∆p = %g∆h gilt, wobei % die Dichte des ¨ Ols, g die Schwerebeschleunigung und ∆h die H¨ ohen¨ anderung am Manometer ist, vereinfacht sich κ schließlich zu
κ ≈ %g∆h 1
%g∆h 1 − %g∆h 2 = ∆h 1
∆h 1 − ∆h 2 .
Dies ist die Formel, die in der Auswertung ben¨ otigt wird. Da sich % rausk¨ urzt,
braucht man es f¨ ur die Auswertung nicht.
3 Versuchsdurchf¨ uhrung
3.1 Methode nach R¨ uchardt
Zun¨ achst sollte ¨ uberpr¨ uft werden, ob an den Gasanschl¨ ussen ein ¨ Uberdruck von 0, 5 − 1 bar eingestellt worden ist. Dies ist wichtig, da der P¨ ompel sonst nicht in Schwingung gebracht werden kann.
Nun wird das auf dem Tisch angebrachte Ventil ge¨ offnet. Der P¨ ompel sollte sich anheben. Dann das Entl¨ uftungsventil ¨ offnen, und die Apparatur ca. 3 Minuten mit dem Gas durchsp¨ ulen. Dieser beschleunigte Gasaustausch soll- te bei jedem Gaswechsel durchgef¨ uhrt werden.
Nun wird das Entl¨ uftungsventil geschlossen, und das am Tisch befestigte Ventil so weit aufgedreht, bis sich eine symmetrische Schwingung um die kleine ¨ Offnung im Glasrohr ergibt. Es ist darauf zu achten, dass der P¨ ompel nicht an das obere Ende des Rohres anschl¨ agt.
Die Stoppuhr wird auf die gew¨ unschte Anzahl der Schwingungen eingestellt, und die Messung mit dem Taster gestartet. Die Schwingungsdauer ist f¨ ur jede der drei Gasarten zu messen: 10 mal f¨ ur eine Schwingung und jeweils 3 mal f¨ ur 10, 50 und 100 Schwingungen. Es sollte bei jeder Gasart die un- gef¨ ahre Schwingungsamplitude gemessen werden.
Nun sollten noch die Daten an der Apparatur notiert, der Luftdruck im Raum und die Strecke zwischen des Luftschlitzes und dem oberen Ende des Rohres gemessen werden.
3.2 Methode nach Clement-Desormes
Durch den Blasebalg wird der Druck in der Apparatur erh¨ oht. Nach eini- ger Zeit wird der ¨ Uberdruck ∆h 1 am Manometer abgelesen. Nun wird das Entl¨ uftungsventil f¨ ur kurze Zeit ge¨ offnet. Nach einiger Zeit wird wieder der Uberdruck ∆h ¨ 2 abgelesen. Die Messung sollte mehrmals f¨ ur verschiedene Offnungszeiten [ca. 0,1 s; 1 s; 5 s] wiederholt werden. ¨
4 Auswertung
4.1 R¨ uchardt
κ l¨ asst sich nun mit der in 2.5 hergeleiteten Formel berechnen. Es gilt κ = 64m ef f V
T 2 pd 4 .
Die effektive Masse m ef f berechnet sich aus der Summe der Masse des P¨ ompels und der mitschwingenden Lufts¨ aule. Es gilt
m ef f = m + m l = m + hA%,
wobei m die Masse des P¨ ompels, h = 11, 5 cm die Strecke zwischen dem Luftschlitz und dem oberen Rohrende, A die Querschnittsfl¨ ache des Rohres und % = 1, 204 kg/m 3 die Dichte der Luft bei einer Temperatur von 20 ◦ C ist.
p ist der Druck in der Apparatur f¨ ur den p = b + mg
A
gilt. Dabei ist b der ¨ außere Luftdruck und g die Schwerebeschleunigung.
Wir maßen einen Luftdruck von b = 742, 8 Torr = 742, 8 · 101325/760 P a = 99031 P a mit einem Fehler von σ b = 0, 1 Torr ≈ 14 P a. Es ergibt sich ein Druck von p = 99662 P a mit dem Fehler σ p = σ b = 14 P a.
An der Apparatur lasen wir folgende Werte ab: m = 4, 954 g, d = 9, 905 mm und V = 2211 cm 3 .
Es ergaben sich folgende Werte f¨ ur κ:
Perioden κ Luft σ κ
Lκ Argon σ κ
Aκ CO 2 σ κ
C1 1.47148 0.01472 1.68498 0.01686 1.39122 0.01392 10 1.46735 0.01468 1.61497 0.01616 1.40856 0.01409 50 1.47023 0.01471 1.64452 0.01645 1.39972 0.014 100 1.46855 0.01469 1.68363 0.01684 1.37434 0.01375 Der jeweilige Fehler ergibt sich durch das Gesetz der Fehlerfortpflanzung:
σ κ = s
σ 2 p ∂κ
∂p 2
+ σ T 2 ∂κ
∂T 2
= 64V m ef f T 2 d 4 p
s σ p 2 p 2 + 4σ T 2
T 2 , wobei σ T = 0, 000001 + Messwert · 0, 005 s der systematische Fehler der Lichtschranke ist.
Bestimmt man den gewichteten Mittelwert ergibt sich
κ Luft σ κ
Lκ Argon σ κ
Aκ CO 2 σ κ
C1.469 0.008 1.656 0.009 1.393 0.007 Durch den in 2.4 hergeleiteten Zusammenhang
κ = f + 2
f ⇔ f = 2
κ − 1
k¨ onnen wir nun die Freiheitsgrade der jeweiligen Gase berechnen. F¨ ur den entsprechenden Fehler gilt
σ f = s
σ κ 2 ∂f
∂κ 2
= 2 σ κ
(κ − 1) 2 . f Luft σ f
Lf Argon σ f
Af CO 2 σ f
C4.26 0.07 3.05 0.04 5.09 0.09 4.2 Clement-Desormes
Nach der in 2.6 hergeleiteten Formel berechnet sich κ durch κ = ∆h 1
∆h 1 − ∆h 2 .
Der Fehler ergibt sich durch das Gesetz der Fehlerfortpflanzung zu
σ κ = s
σ ∆h 2
1
∆h 2
(∆h 1 − ∆h 2 ) 2 2
+ σ ∆h 2
2
∆h 1
(∆h 1 − ∆h 2 ) 2 2
.
Wobei wir σ ∆h
1= σ ∆h
2= 0, 002 m gesch¨ atzt haben.
Offnungszeit ¨ ∆h 1 ∆h 2 κ L σ κ
L0.1 s 43 29 3.071 0.001
1 s 58.5 28 1.918 0.001 5 s 62.5 11.5 1.226 0.001
5 Diskussion
5.1 R¨ uchardt
Da Luft und CO 2 5 Freiheitsgrade 1 haben [siehe dazu Versuch 06: Spezifische W¨ arme der Luft und Gasthermometer], w¨ are der theoretisch erwartete Wert von κ
κ L,C = f + 2 f = 7
5 = 1, 4.
1