AUS DEM LEHRSTUHL FÜR ANÄSTHESIOLOGIE Direktor: Professor Dr. Bernhard M. Graf
DER FAKULTÄT FÜR MEDIZIN DER UNIVERSITÄT REGENSBURG
Frequency of delirium in non-cardiac surgical and medical intensive-care patients — results from a comparative, prospective, observational study
Inaugural – Dissertation zur Erlangung des Doktorgrades
der Medizin
der
Fakultät für Medizin der Universität Regensburg
vorgelegt von Marius Philipp Zeder
2018
AUS DEM LEHRSTUHL FÜR ANÄSTHESIOLOGIE Direktor: Professor Dr. Bernhard M. Graf
DER FAKULTÄT FÜR MEDIZIN DER UNIVERSITÄT REGENSBURG
Frequency of delirium in non-cardiac surgical and medical intensive-care patients — results from a comparative, prospective, observational study
Inaugural – Dissertation zur Erlangung des Doktorgrades
der Medizin der
Fakultät für Medizin der Universität Regensburg
vorgelegt von Marius Philipp Zeder
2018
Dekan: Prof. Dr. Dr. Torsten E. Reichert 1. Berichterstatter: Prof. Dr. Thomas Bein
2. Berichterstatter: Priv.-Doz. Dr. med. habil. Matthias Lubnow Tag der mündlichen Prüfung: 09.04.2019
Inhaltsverzeichnis
1. „Die Häufigkeit des Delirs bei nicht-herzchirurgischen operativen und internistischen Intensivpatienten – Ergebnisse einer komparativen, prospektiven Observationsstudie“
(Übersetzung, deutsch)
1.1. Einleitung...4
1.2. Methodik...5
I. Studiendesign und Population...5
II. Statistische Analyse...6
1.3. Ergebnisse...7
1.4. Diskussion...8
1.5. Zusammenfassung...11
1.6. Abkürzungsverzeichnis...11
1.7. Anhang...12
1.8. Literatur...16
2. Publikation (Original, englisch)...20
3. Danksagung...28
4. Lebenslauf...29
1. Die Häufigkeit des Delirs bei nicht-herzchirurgischen operativen und internistischen Intensivpatienten – Ergebnisse einer komparativen, prospektiven, Observationsstudie
1.1. Einleitung
Das Delir ist mit einer Inzidenz zwischen 10 und 92 % die häufigste psychiatrische Erkrankung bei Intensivpatienten [1–4] und ist mit einer höheren Mortalität verglichen mit nicht deliranten Patienten assoziiert [5, 6]. Trotz der hohen Inzidenz wird das Delir häufig vom Intensivpersonal übersehen [7] und Screeninguntersuchungen sind unzureichend auf deutschen Intensivstationen implementiert [8,9].
Das Delir wird vom Diagnostic and Statistical Manual of Mental Disorders (DSM-IV) über ein eingeschränktes Bewusstsein, Defizite der Konzentrations- und Aufnahmefähigkeit, Aufmerksamkeitsstörungen sowie Denkstörungen definiert, kann nicht durch vorbestehende Erkrankungen erklärt werden und entsteht akut mit einem fluktuierenden Verlauf [10].
Zusätzlich listet die Internationale statistische Klassifikation der Krankheiten (ICD-10) Störungen der psychomotorischen Aktivität, der Emotionalität und des Schlaf-Wach- Rhythmus als Kriterien für das Delir [11]. In kürzlich durchgeführten Studien wurden viele Risikofaktoren für das Delir untersucht und es wurde herausgefunden, dass das Delir ein unabhängiger Faktor für ein ungünstiges klinisches Outcome ist [5, 6]. Somit ist die Prävention und frühe Behandlung des Delirs ein wichtiges Ziel auf Intensivstation. So scheinen die Verwendung von Ohrstöpseln, mehr Tageslicht und frühe Mobilisation der Entwicklung eines Delirs vorzubeugen [12]. Zusätzlich verringerte beispielsweise die Implementierung des sogenannten “ABCDE-Bundle” – ein Protokoll zur Verringerung der Häufigkeit des Delirs durch eine verbesserte Respiratorentwöhnung, bewusstere Verabreichung von Analgetika und Sedativa, verbessertes Delirmonitoring und Frühmobilisation - signifikant die Prävalenz und Dauer des Delirs [13].
Die Pathophysiologie des Delirs ist bis heute schlecht verstanden. Es gibt sieben weitgehend komplementäre Theorien über die Entwicklung des Delirs, welche neuroinflammatorische Prozesse, neuronales Altern, oxidativen Stress, Mangel an Neurotransmittern, neuroendokrine Faktoren, Fehlregulation des Tag-Nacht-Rhythmus und Verschaltungsprobleme beinhalten [14]. Es wurde gezeigt, dass Inflammation [15], geringes Serumalbumin [16], die Verwendung von Analgetika [1] und erhöhte Volumenzufuhr im OP – vorranging bei herzchirurgischen Patienten [17] – mit einem erhöhten Risiko für Delir einhergehen.
Operationen können zu systemischer Immunsuppression und proinflammatorischen Phasen führen [18]. Zusätzlich sind anhaltende entzündliche Prozesse [19] und Sepsis [20] häufige Komplikationen auf operativen Intensivstationen.
Daher haben wir die Hypothese aufgestellt, dass – wenn höherer inflammatorischer Stress aufgrund vorangegangener Operation mit Delir vergesellschaftet sein könnte [15,21] – die Inzidenz des Delirs bei Intensivpatienten nach Trauma oder nicht-herzchirurgischen Operationen höher im Vergleich zu internistischen Intensivpatienten ist.
Die Ziele dieser Studie waren es, die Häufigkeit des Delirs auf operativer und internistischer Intensivstation zu vergleichen und Risikofaktoren für die Entwicklung eines Delirs mittels multivariater Analyse zu bestimmen.
1.2. Methodik
I. Studiendesign und Population
Es wurde eine prospektive Studie auf zwei Intensivstationen des Universitätsklinikums Regensburg durchgeführt: Eine operative Intensivstation mit 26 Betten (SICU) und eine internistische Intensivstation mit 14 Betten (MICU). Die Ethikkommission der Universität Regensburg stimmte der Studie zu (Bestätigungsnummer 15-101-0101). Nach einer zweiwöchigen Pilotphase, in der Case Report Form (CRF) und das Studienprotokoll getestet wurden, wurden alle Patienten, die zwischen Juni und November 2015 auf die Intensivstationen aufgenommen und für mindestens einen Tag behandelt wurden, mithilfe der Confusion Assessment Method for the ICU (CAM-ICU) mindestens an Tag eins, drei und fünf nach Aufnahme auf die Intensivstation (nicht-beatmete Patienten) oder nach Extubation (beatmete Patieten) auf das Bestehen eines Delirs untersucht. Die CAM-ICU ist ein validierter Test mit hoher Spezifität und guter Sensitivität, um Delir auf Intensivstationen zu diagnostizieren [22]. Einschlusskriterien für das Screening waren: ein Richmond Agitation Scale Score von -3 oder höher [23], das Fehlen von mechanischer Beatmung sowie keine Kontraindikationen für das Screening mittels CAM-ICU. Falls Patienten nach Tag eins auf eine andere Station verlegt wurden, wurde das Screening dort fortgesetzt. In dem Fall, dass Patienten länger als fünf Tage auf Intensivstation verblieben, wurden sie weiterhin bis zur Verlegung alle zwei Tage untersucht.
Des Weiteren wurden folgende Variablen aufgenommen: C-reaktives Protein (CRP), Harnstoff, Albumin und Procalcitonin aus dem Serum; arterieller pH-Wert, Hämoglobin,
Blutzucker und Elektrolyte aus den morgendlichen 8-Uhr Blutgasanalysen (alle Werte am ersten Tag der Delirbeurteilung). Außerdem wurden die kumulativen Dosen von Sedativa (Propofol, Lorazepam, Midazolam) und Analgetika (Morphin, Hydromorphon, Sufentanyl, Oxycodon/Naloxon) sowie vasoaktiver (Noradrenalin, Clonidin) und psychoaktiver Medikation (Levomepromazin, Promethazin, Quetiapin, Melperon, Haloperidol) im Zeitraum von 24 Stunden vor dem jeweiligen Screening erfasst (Tag 1, 3 und 5). Die Gabe von Schmerzmitteln wurde mittels der Visuellen Analogskala standardisiert.
Die Körpertemperatur, arterielle Sauerstoffsättigung und der mittlere arterielle Druck während des Screenings sowie das Alter, Geschlecht, der Simplified Acute Physiology Score (SAPS) der ersten 24 Stunden nach Aufnahme, der Hauptaufnahmegrund auf Intensivstation, die Dauer der vorangegangen maschinellen Beatmung und die Dauer des kompletten Intensivaufenthaltes wurden dokumentiert. Zusätzlich wurden die höchsten Werte des Aufenthaltes von Bilirubin und Kreatinin erfasst. All diese Daten wurden aus dem auf beiden Intensivstationen verwendeten Patientendatenmanagementsystem gewonnen (Metavision, iMDsoft, Düsseldorf, Germany).
Alle Screeninguntersuchungen wurden von einem Untersucher (MZ) nach einem erweiterten, intensivierten Training durch einen erfahrenen Intensivmediziner (TB) durchgeführt.
II. Statistische Analyse
Die statistischen Berechnungen wurden mit SPSS Statistics (IBM Corp. Released 2015. IBM SPSS Statistics for Windows, Version 23.0. Armonk, NY: IBM Corp.) durchgeführt. Das Signifikanzniveau wurde bei einem p-Wert von <0,05 definiert.
Quantitative Variablen wurden mit dem arithmetischen Mittel ± Standardabweichung (SD), Median und Interquartilsabstand (IQR) angegeben, kategorische Variablen mit Zahl und Prozent. Zur Untersuchung der Unterschiede zwischen internistischen und operativen Patienten wurden der Student’s T–test für normalverteilte sowie der Mann–Whitney U–Test für nicht-normalverteilte Variablen verwendet. Die Ergebnisse beider Tests sind mit Mittelwert ± Standardabweichung in Text und Tabelle angezeigt, um die Lesbarkeit zu verbessern. Mit Hilfe des Shapiro-Wilk Tests wurde auf Normalverteilung untersucht (lediglich die Körpertemperatur zeigte Normalverteilung). Zum Vergleich von kategorischen Variablen – Geschlecht, Intubation, Tracheotomie und Anwendung von psychoaktiven Medikamenten – wurde der Pearson’s Chi–Quadrat Test verwendet und Odds-Ratios nach Mantel-Haenszel berechnet.
Um Risikofaktoren für die Entwicklung des Delirs zu identifizieren, wurden univariable Modelle der logistischen Regression erstellt. Die hier verwendeten Variablen waren die signifikanten Variablen von vorherigen Tests und Variablen, die in der Literatur als Prädiktoren für Delir beschrieben wurden.
Außerdem wurde ein Modell der multivariablen logistischen Regression mit den signifikanten Prädiktoren der univariablen Analyse errechnet. Die Ergebnisse beider logistischen Regressionen sind mit Hilfe von Odds Ratios (OR) mit einem 95%-Konfidenzintervall (CI) angegeben.
1.3. Ergebnisse
142 Patienten wurden auf das Bestehen eines Delirs untersucht. Vier Patienten wurden aus der Studie ausgeschlossen, da sie Ausschlusskriterien erfüllten, die Datenerfassung unmöglich war oder die Screeninguntersuchungen nicht komplett waren. 138 Patienten wurden in die Studie eingeschlossen (SICU: 71, MICU: 67). Es wurden mehr männliche Patienten untersucht (n=88, 63,8%). 86 Patienten (62,3%) wurden während ihres Aufenthaltes mittels Endotrachealtubus beatmet und sieben Patienten (5,1%) wurden tracheotomiert. 32,6% aller untersuchten Patienten entwickelten ein Delir und 3,6% starben während des Aufenthaltes auf Intensivstation.
Das durchschnittliche Alter lag bei 61,7 ± 16,3 Jahren (Median 65, IQR 21) mit einem SAPS von 36,5 ± 14,4 (36, IQR 20). Die Patienten wurden im Durchschnitt 2,6 ± 4,2 Tage (1, IQR 3) maschinell beatmet und ihre Aufenthaltsdauer auf Intensivstation betrug 7,2 ± 6,2 Tage (5, IQR 7). Die Charakteristika der Kohorte sind in Tabelle 1 dargestellt.
Die Verabreichung von psychoaktiver Medikation war mit einer erhöhten Inzidenz des Delirs vergesellschaftet (53,3 % vs 8,6 %) und Patienten mit Delir bekamen höhere kumulative Dosen von psychoaktiver Medikation verglichen mit Patienten ohne Delir: Haloperidol (1,43
± 2,61mg vs 0,17 ± 1,08mg, p <0,001), Quetiapin (15,56 ± 50,08mg vs 3,23 ± 31,11mg, p = 0,001), Promethazin (4,72 ± 17,93mg vs 0,54 ± 5,18mg, p = 0,007), Clonidin (532,59 ± 1308,62µg vs 41,21 ± 202,26µg, p = 0,009), Melperon (1,78 ± 8,27mg vs 0,00mg ± 0, p = 0,012), Levomepromazin (2,36 ± 6,70mg vs 0,13 ± 1,30mg, p = 0,002). Sie erhielten außerdem höhere Dosen an Benzodiazepinen (Lorazepam, Midazolam), Morphin, Propofol und Sufentanyl. Patienten, die am Delir litten, erhielten dagegen signifikant weniger Oxycodon/Naloxon als Patienten ohne Delir.
Die Laborwerte und Blutgasanalysen zeigten signifikante Unterschiede zwischen Patienten mit und ohne Delir bei den Werten von Serumalbumin, Harnstoff, CRP, Natrium, Hämoglobin, Kreatinin und Bilirubin. Zusätzlich wiesen Patienten ohne Delir einen signifikant niedrigeren SAPS, ein niedrigeres Alter, eine kürzere Beatmungsdauer und einen kürzeren Gesamtaufenthalt auf Intensivstation auf. Der Chi–Quadrat Test zeigte, dass Patienten mit Delir signifikant häufiger intubiert worden waren oder bei Ihnen eine Tracheotomie durchgeführt worden war. Die signifikanten Unterschiede zwischen Patienten mit und ohne Delir sind in Tabelle 2 dargestellt.
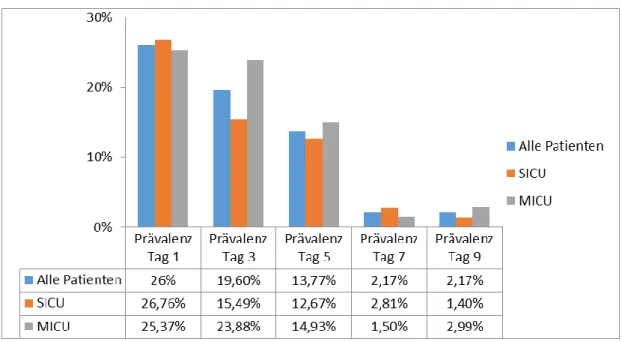
Wir haben außerdem die Unterschiede in der Prävalenz des Delirs zwischen internistischer und operativer Intensivstation an den einzelnen Screeningtagen untersucht. Es scheint, dass Patienten auf internistischer Intensivstation tendenziell höhere Delirraten an späteren Screeningtagen aufwiesen, wobei dieser Unterschied sich jedoch an keiner Stelle als signifikant erwies (Darstellung 1).
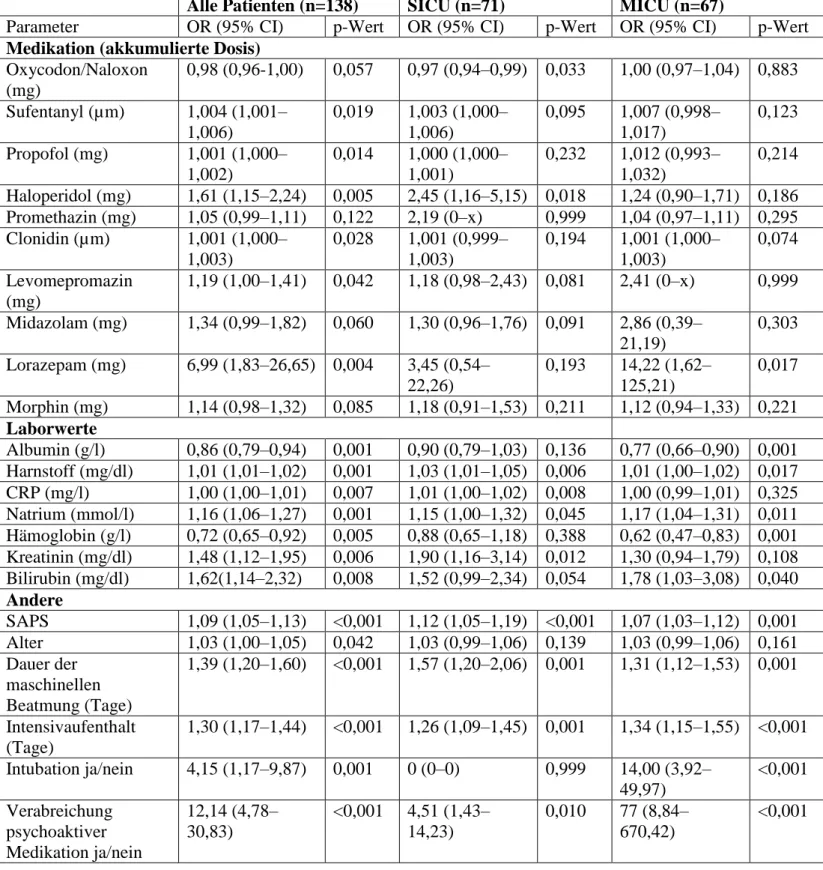
Um die unterschiedlichen Risikofaktoren für Delir im ganzen Kollektiv sowie für SICU und MICU im Speziellen zu untersuchen, haben wir logistische Regressionsanalysen durchgeführt (Tabelle 3).
Wie in Tabelle 3 gezeigt, sind signifikante Risikofaktoren für die Entwicklung eines Delirs im kompletten Kollektiv die Anwendung von psychoaktiven Medikamenten, Propofol und Lorazepam. Außerdem wurden erhöhte Werte von Harnstoff, CRP, Natrium, Kreatinin und Bilirubin sowie verringerte Werte von Albumin und Hämoglobin als signifikante Risikofaktoren identifiziert. Weitere negative Faktoren waren hohes Alter, ein hoher SAPS, längere Beatmungsdauer und Intensivaufenthalt sowie Intubation und Tracheotomie.
Unabhängige Risikofaktoren wurden mittels multivariabler logistischer Regression errechnet.
Dabei erwiesen sich Kreatinin, C-reaktives Protein und eine längere Beatmungsdauer als unabhängige Risikofaktoren im kompletten Studienkollektiv (Tabelle 4).
1.4. Diskussion
Die Inzidenz des Delirs bei Intensivpatienten ist hoch. Es wurden verschiedene Faktoren wie hohes Alter, kognitive Einschränkungen, Raucheranamnese und Alkoholmissbrauch, Apolipoprotein E4 Polymorphismus, Depressionen und Seh- und Hörstörungen als Prädiktoren für das Delir festgestellt. Zusätzlich sind Faktoren, die mit kritischen Erkrankungen assoziiert sind – wie Azidose, Anämie, Fieber, Infektion und Sepsis,
Hypotension und respiratorische Erkrankungen – mit dem Delir vergesellschaftet [5,24–30].
Ein Delir kann außerdem von Medikamenten wie Opioiden und Benzodiazepinen, Immobilisation und Schlafstörungen induziert werden [31–33]. Da inflammatorische Prozesse als spezielle Risikofaktoren für das Delir identifiziert wurden [15,21] und eine erhöhte Inzidenz des Delirs bei herzchirurgischen Patienten gefunden wurde [17], interessierten wir uns für die Frequenz des Delirs bei Patienten, die nicht-herzchirurgische Operationen durchliefen, im Vergleich zu internistischen Patienten. Nach unserem Wissen wurde noch keine solche Untersuchung durchgeführt.
Die Hauptergebnisse unserer prospektiven Studie waren: 1) Die Inzidenz zwischen den nicht- herzchirurgischen operativen Patienten und den internistischen Patienten unterschied sich nicht. 2) Die Patienten mit Delir erhielten signifikant höhere Dosen an psychoaktiven, sedierenden und analgetischen Medikamenten in beiden Gruppen und sie wiesen niedrigere Werte von Serumalbumin und Hämoglobin, aber höhere Werte an Kreatinin, Harnstoff, CRP und Bilirubin auf. 3) In der multivariaten logistischen Regressionsanalyse stellten sich in der kompletten Studiengruppe die Dauer der mechanischen Beatmung, das Kreatinin und CRP als unabhängige Risikofaktoren für das Delir dar. 4) Patienten ohne Delir erhielten signifikant höhere Dosen an Oxycodon/Naloxon, dem einzigen Opioid mit einem Trend hin zu einer
„Delir-protektiven“ Wirkung.
In einer aktuellen prospektiven Studie einer gemischten Population von Intensivpatienten zeigten Patienten mit Delir signifikant höhere Werte des CRP als Patienten ohne Delir (120,5 mg/l vs 57,5mg/l; p = 0,0001) und das CRP war in der logistischen Regressionsanalyse ein unabhängiger Risikofaktor für das Delir [15]. Dementsprechend wurde in unserer Patientenkohorte ein sehr ähnliches Muster bei Patienten mit und ohne Delir erkannt.
Interessanterweise war die Frequenz des Delirs in beiden Gruppen sehr ähnlich, obwohl die Patienten auf operativer Intensivstation signifikant höhere CRP-Werte aufwiesen als die internistischen Patienten. Eine mögliche Erklärung für dieses Ergebnis könnte die erhöhte Anwendung des Analgetikums Oxycodon/Naloxon bei operativen Patienten sein. In einer gegenwärtigen Studie an Krebspatienten wurde der Effekt von drei verschiedenen, dem Patienten erstmals verabreichten Opioiden auf die Entwicklung eines Delirs untersucht [34].
Dabei wurde die höchste Inzidenz in der Morphingruppe (28,9 %), verglichen mit der Oxycodongruppe (19,5 %) und der Fentanylgruppe (8,6 %, in unserer Studie nicht untersucht) gefunden. Des Weiteren haben Maddocks et al. in einer älteren klinischen Studie die Abschwächung von morphin-induziertem Delir durch die Substitution durch Oxycodon
beschrieben [35]. Nichtsdestotrotz muss unsere Hypothese, dass Oxycodon/Naloxon die Frequenz des Delirs bei Intensivpatienten senkt, mit Hilfe eines spezifischen, randomisierten und prospektiven Studiendesigns untersucht werden.
In unserer Multivarianzanalyse wurde die Erhöhung des Serumkreatinins als ein unabhängiger Prädiktor für das Delir – vor allem bei operativen Patienten – identifiziert. Renale Dysfunktion präsentiert sich bei operativen Intensivpatienten oft als akutes Nierenversagen, wohingegen internistische Intensivpatienten häufig mit chronischen Nierenschäden eingewiesen werden [36,37]. In vergleichbarer Weise wurde in einer aktuellen Studie mit 466 Intensivpatienten gezeigt, dass Patienten mit einem akuten Nierenversagen der Stufe 2 und 3 häufiger an Delir leiden (OR 1.55; 95 % CI: 1.07, 2.26) als Patienten ohne akutem oder akut auf chronischem Nierenversagen [38].
In unserer Studie wiesen die operativen Patienten signifikant niedrigere und Patienten ohne Delir signifikant höhere Serumalbuminspiegel auf (Tabelle 1 und 3). In einer prospektiven, observativen Kohortenstudie von 34 herzchirurgischen Patienten, bei welchen Bypassoperationen durchgeführt wurden, zeigten Patienten mit Delir signifikant niedrigere Serumalbuminlevel 24 und 48 Stunden postoperativ als solche ohne Delir [39]. Dieses Ergebnis ist im Hinblick auf unsere Hauptergebnisse nicht einfach zu interpretieren, da wir den zu erwartenden Unterschied bei operativen und internistischen Patienten in der Inzidenz des Delirs trotz der differierenden Serumalbuminspiegel in unserer Studie nicht beobachten konnten. Daher stellen wir die Hypothese auf, dass die Entwicklung eines Delirs ein multifaktorieller Prozess ist und – in einem Setting auf Intensivstation – nicht einer Variable zuzuschreiben ist.
Unsere Studie hat einige Stärken und Einschränkungen. Die Stärken sind: Wir führten ein präzises und fortlaufendes Screening in definierten operativen und internistischen Patientengruppen durch. Die Screenings wurden von einem gut geschulten Untersucher durgeführt und wichtige Kovariablen wurden aufgenommen. Dagegen ist die Studie eine Single-Center Studie und relativ geringe Patientenzahlen wurden in die Gruppen rekrutiert.
Trotz der kleinen Studienpopulation konnten wir wichtige Ergebnisse mittels multivariater Analysen zeigen.
1.5. Zusammenfassung
Die Frequenz des Delirs unterscheidet sich nicht zwischen internistischen und nicht- herzchirurgischen operativen Intensivpatienten, obwohl letztere durch stärkere inflammatorische Prozesse (C-reaktives Protein) charakterisiert sind, was als an unabhängiger Prädiktor für das Delir ermittelt wurde. Eine mögliche Erklärung ist die Verabreichung signifikant höhere Dosen an Oxycodon/Naloxon bei operativen Patienten, was eine Delir- protektive Wirkung aufweisen könnte. Es muss aber festgestellt werden, dass auf jeden Fall größere Patientengruppen und Doppelblindstudien benötigt werden, um diese Hypothese zu beweisen, vor allem da lediglich die univariable, nicht multivariable logistische Regressionsanalyse signifikante Effekte zeigte.
1.6. Abkürzungsverzeichnis
ICU – Intensive-care unit
DSM–IV – Diagnostic and Statistical Manual of Psychiatric Diseases IV SICU – Surgical/trauma intensive-care unit
MICU – Medical intensive-care unit CRF – Case report form
CAM–ICU – Confusion Assessment Method for the ICU RASS – Richmond Agitation Scale Score
CRP – C-reactive protein
SAPS – Simplified Acute Physiology Score SD – Standard deviation
IQR – Interquartile range OR – Odds ratio
CI – Confidence interval
1.7. Anhang
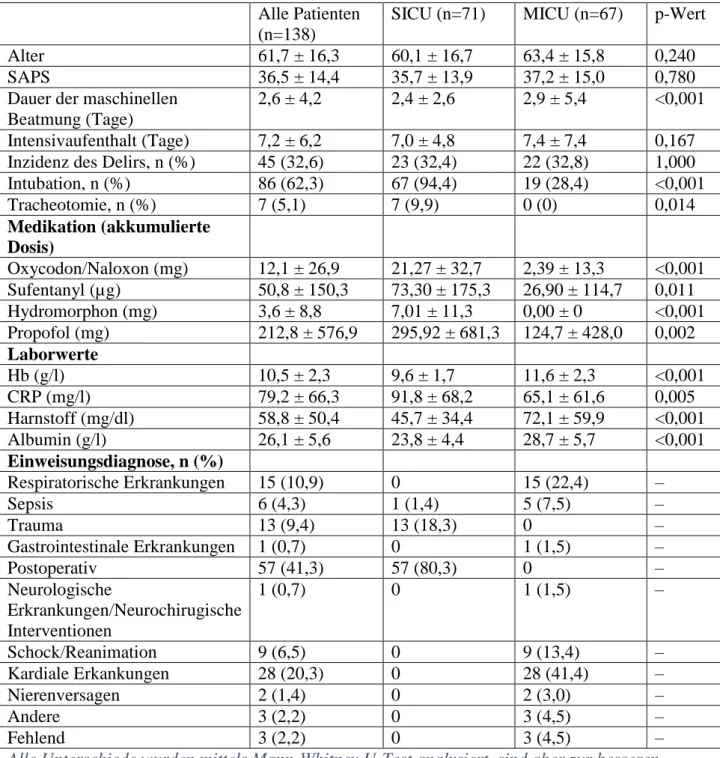
Tabelle 1: Charakteristika der Studienpatienten Alle Patienten (n=138)
SICU (n=71) MICU (n=67) p-Wert
Alter 61,7 ± 16,3 60,1 ± 16,7 63,4 ± 15,8 0,240
SAPS 36,5 ± 14,4 35,7 ± 13,9 37,2 ± 15,0 0,780
Dauer der maschinellen Beatmung (Tage)
2,6 ± 4,2 2,4 ± 2,6 2,9 ± 5,4 <0,001 Intensivaufenthalt (Tage) 7,2 ± 6,2 7,0 ± 4,8 7,4 ± 7,4 0,167 Inzidenz des Delirs, n (%) 45 (32,6) 23 (32,4) 22 (32,8) 1,000
Intubation, n (%) 86 (62,3) 67 (94,4) 19 (28,4) <0,001
Tracheotomie, n (%) 7 (5,1) 7 (9,9) 0 (0) 0,014
Medikation (akkumulierte Dosis)
Oxycodon/Naloxon (mg) 12,1 ± 26,9 21,27 ± 32,7 2,39 ± 13,3 <0,001 Sufentanyl (µg) 50,8 ± 150,3 73,30 ± 175,3 26,90 ± 114,7 0,011
Hydromorphon (mg) 3,6 ± 8,8 7,01 ± 11,3 0,00 ± 0 <0,001
Propofol (mg) 212,8 ± 576,9 295,92 ± 681,3 124,7 ± 428,0 0,002 Laborwerte
Hb (g/l) 10,5 ± 2,3 9,6 ± 1,7 11,6 ± 2,3 <0,001
CRP (mg/l) 79,2 ± 66,3 91,8 ± 68,2 65,1 ± 61,6 0,005
Harnstoff (mg/dl) 58,8 ± 50,4 45,7 ± 34,4 72,1 ± 59,9 <0,001
Albumin (g/l) 26,1 ± 5,6 23,8 ± 4,4 28,7 ± 5,7 <0,001
Einweisungsdiagnose, n (%)
Respiratorische Erkrankungen 15 (10,9) 0 15 (22,4) –
Sepsis 6 (4,3) 1 (1,4) 5 (7,5) –
Trauma 13 (9,4) 13 (18,3) 0 –
Gastrointestinale Erkrankungen 1 (0,7) 0 1 (1,5) –
Postoperativ 57 (41,3) 57 (80,3) 0 –
Neurologische
Erkrankungen/Neurochirugische Interventionen
1 (0,7) 0 1 (1,5) –
Schock/Reanimation 9 (6,5) 0 9 (13,4) –
Kardiale Erkankungen 28 (20,3) 0 28 (41,4) –
Nierenversagen 2 (1,4) 0 2 (3,0) –
Andere 3 (2,2) 0 3 (4,5) –
Fehlend 3 (2,2) 0 3 (4,5) –
Alle Unterschiede wurden mittels Mann-Whitney U-Test analysiert, sind aber zur besseren Lesbarkeit mit Mittelwert ± Standardabweichung (SD) angeben
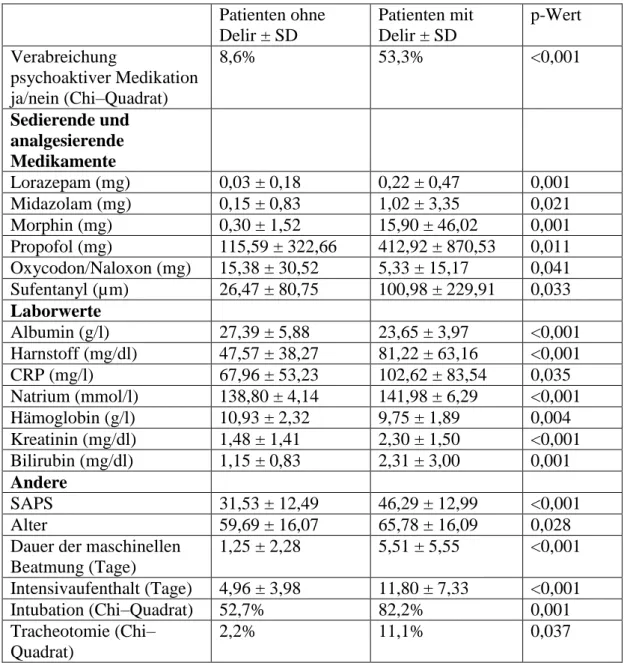
Tabelle 2: Verabreichung psychoaktiver Medikation, durchschnittlich verabreichte Dosen von Sedativa und Analgetika, Laborwerte und andere Variablen im Vergleich zwischen Patienten mit oder ohne Delir
Patienten ohne Delir ± SD
Patienten mit Delir ± SD
p-Wert Verabreichung
psychoaktiver Medikation ja/nein (Chi–Quadrat)
8,6% 53,3% <0,001
Sedierende und analgesierende Medikamente
Lorazepam (mg) 0,03 ± 0,18 0,22 ± 0,47 0,001
Midazolam (mg) 0,15 ± 0,83 1,02 ± 3,35 0,021
Morphin (mg) 0,30 ± 1,52 15,90 ± 46,02 0,001
Propofol (mg) 115,59 ± 322,66 412,92 ± 870,53 0,011 Oxycodon/Naloxon (mg) 15,38 ± 30,52 5,33 ± 15,17 0,041 Sufentanyl (µm) 26,47 ± 80,75 100,98 ± 229,91 0,033 Laborwerte
Albumin (g/l) 27,39 ± 5,88 23,65 ± 3,97 <0,001 Harnstoff (mg/dl) 47,57 ± 38,27 81,22 ± 63,16 <0,001
CRP (mg/l) 67,96 ± 53,23 102,62 ± 83,54 0,035
Natrium (mmol/l) 138,80 ± 4,14 141,98 ± 6,29 <0,001
Hämoglobin (g/l) 10,93 ± 2,32 9,75 ± 1,89 0,004
Kreatinin (mg/dl) 1,48 ± 1,41 2,30 ± 1,50 <0,001
Bilirubin (mg/dl) 1,15 ± 0,83 2,31 ± 3,00 0,001
Andere
SAPS 31,53 ± 12,49 46,29 ± 12,99 <0,001
Alter 59,69 ± 16,07 65,78 ± 16,09 0,028
Dauer der maschinellen Beatmung (Tage)
1,25 ± 2,28 5,51 ± 5,55 <0,001 Intensivaufenthalt (Tage) 4,96 ± 3,98 11,80 ± 7,33 <0,001
Intubation (Chi–Quadrat) 52,7% 82,2% 0,001
Tracheotomie (Chi–
Quadrat)
2,2% 11,1% 0,037
Alle Unterschiede wurden mittels Mann-Whitney U-Test analysiert, sind aber zur besseren Lesbarkeit mit Mittelwert ± Standardabweichung (SD) angeben
Tabelle 3: Univariable logistische Regressionsmodelle von mit Delir assoziierten Faktoren bei allen Patienten, auf SICU und MICU
Alle Patienten (n=138) SICU (n=71) MICU (n=67)
Parameter OR (95% CI) p-Wert OR (95% CI) p-Wert OR (95% CI) p-Wert
Medikation (akkumulierte Dosis) Oxycodon/Naloxon
(mg)
0,98 (0,96-1,00) 0,057 0,97 (0,94–0,99) 0,033 1,00 (0,97–1,04) 0,883 Sufentanyl (µm) 1,004 (1,001–
1,006)
0,019 1,003 (1,000–
1,006)
0,095 1,007 (0,998–
1,017)
0,123 Propofol (mg) 1,001 (1,000–
1,002)
0,014 1,000 (1,000–
1,001)
0,232 1,012 (0,993–
1,032)
0,214 Haloperidol (mg) 1,61 (1,15–2,24) 0,005 2,45 (1,16–5,15) 0,018 1,24 (0,90–1,71) 0,186 Promethazin (mg) 1,05 (0,99–1,11) 0,122 2,19 (0–x) 0,999 1,04 (0,97–1,11) 0,295 Clonidin (µm) 1,001 (1,000–
1,003)
0,028 1,001 (0,999–
1,003)
0,194 1,001 (1,000–
1,003)
0,074 Levomepromazin
(mg)
1,19 (1,00–1,41) 0,042 1,18 (0,98–2,43) 0,081 2,41 (0–x) 0,999 Midazolam (mg) 1,34 (0,99–1,82) 0,060 1,30 (0,96–1,76) 0,091 2,86 (0,39–
21,19)
0,303 Lorazepam (mg) 6,99 (1,83–26,65) 0,004 3,45 (0,54–
22,26)
0,193 14,22 (1,62–
125,21)
0,017 Morphin (mg) 1,14 (0,98–1,32) 0,085 1,18 (0,91–1,53) 0,211 1,12 (0,94–1,33) 0,221 Laborwerte
Albumin (g/l) 0,86 (0,79–0,94) 0,001 0,90 (0,79–1,03) 0,136 0,77 (0,66–0,90) 0,001 Harnstoff (mg/dl) 1,01 (1,01–1,02) 0,001 1,03 (1,01–1,05) 0,006 1,01 (1,00–1,02) 0,017 CRP (mg/l) 1,00 (1,00–1,01) 0,007 1,01 (1,00–1,02) 0,008 1,00 (0,99–1,01) 0,325 Natrium (mmol/l) 1,16 (1,06–1,27) 0,001 1,15 (1,00–1,32) 0,045 1,17 (1,04–1,31) 0,011 Hämoglobin (g/l) 0,72 (0,65–0,92) 0,005 0,88 (0,65–1,18) 0,388 0,62 (0,47–0,83) 0,001 Kreatinin (mg/dl) 1,48 (1,12–1,95) 0,006 1,90 (1,16–3,14) 0,012 1,30 (0,94–1,79) 0,108 Bilirubin (mg/dl) 1,62(1,14–2,32) 0,008 1,52 (0,99–2,34) 0,054 1,78 (1,03–3,08) 0,040 Andere
SAPS 1,09 (1,05–1,13) <0,001 1,12 (1,05–1,19) <0,001 1,07 (1,03–1,12) 0,001 Alter 1,03 (1,00–1,05) 0,042 1,03 (0,99–1,06) 0,139 1,03 (0,99–1,06) 0,161 Dauer der
maschinellen Beatmung (Tage)
1,39 (1,20–1,60) <0,001 1,57 (1,20–2,06) 0,001 1,31 (1,12–1,53) 0,001
Intensivaufenthalt (Tage)
1,30 (1,17–1,44) <0,001 1,26 (1,09–1,45) 0,001 1,34 (1,15–1,55) <0,001 Intubation ja/nein 4,15 (1,17–9,87) 0,001 0 (0–0) 0,999 14,00 (3,92–
49,97)
<0,001 Verabreichung
psychoaktiver Medikation ja/nein
12,14 (4,78–
30,83)
<0,001 4,51 (1,43–
14,23)
0,010 77 (8,84–
670,42)
<0,001
Tabelle 4: Multivariables logistisches Regressionsmodell der mit Delir assoziierten Faktoren im kompletten Patientenkollektiv
OR (95% CI) p-Wert
Dauer der maschinellen Beatmung (Tage)
1,34 (1,12–1,61) 0,002
Kreatinin (mg/dl) 1,41 (1,04–1,92) 0,028
Bilirubin (mg/dl) 1,37 (0,94–1,98) 0,098
Natrium (mmol/l) 1,13 (0,97–1,28) 0,059
CRP (mg/l) 1,01 (1,00–1,02) 0,022
Albumin (mg/dl) 0,97 (0,86–1,11) 0,675
Oxycodon/Naloxon (mg)
0,99 (0,97–1,01) 0,232
Abbildung 1: Vergleich der Prävalenz des Delirs von SICU und MICU an den Screeningtagen
1.8. Literatur
Quellenverzeichnis
[1] Theuerkauf N, Guenther U. Delir auf der Intensivstation. Med Klin Intensivmed Notfmed 2014;109:129–36.
[2] Pandharipande P, Cotton BA, Shintani A, Thompson J, Pun BT, Morris JA et al.
Prevalence and risk factors for development of delirium in surgical and trauma intensive care unit patients. The Journal Of Trauma 2008;65:34–41.
[3] Pandharipande P, Cotton BA, Shintani A, Thompson J, Costabile S, Truman Pun B et al. Motoric subtypes of delirium in mechanically ventilated surgical and trauma intensive care unit patients. Intensive Care Med 2007;33:1726–31.
[4] Sieber FE, Zakriya KJ, Gottschalk A, Blute M, Lee HB, Rosenberg PB et al. Sedation depth during spinal anesthesia and the development of postoperative delirium in elderly patients undergoing hip fracture repair. Mayo Clinic Proceedings 2010;85:18–26.
[5] Ouimet S, Kavanagh BP, Gottfried SB, Skrobik Y. Incidence, risk factors and consequences of ICU delirium. Intensive Care Med 2007;33:66–73.
[6] Ely EW, Shintani A, Truman B, Speroff T, Gordon SM, Harrell FE et al. Delirium as a predictor of mortality in mechanically ventilated patients in the intensive care unit. JAMA 2004;291:1753–62.
[7] Ely EW, Stephens RK, Jackson JC, Thomason, Jason W W, Truman B, Gordon S et al. Current opinions regarding the importance, diagnosis, and management of delirium in the intensive care unit: a survey of 912 healthcare professionals. Critical Care Medicine
2004;32:106–12.
[8] Saller T, V Dossow V, Hofmann-Kiefer K. Kenntnis und Umsetzung der S3-Leitlinie zum Delirmanagement in Deutschland. Der Anaesthesist 2016;65:755–62.
[9] Günther U, Putensen C. Routinemäßiges Delirmonitoring auf der Intensivstation.
Anästhesiol Intensivmed Notfallmed Schmerzther 2010;45:118–26.
[10] Sass, Henning (op. 2003): Diagnostisches und Statistisches Manual Psychischer Störungen, DSM-IV-TR. 4. Aufl., Textrevision. Göttingen [etc.]: Hogrefe Verl. Für Psychologie. 2003.
[11] Graubner, Bernd (Hg.) (2014): ICD-10-GM 2015 Systematisches Verzeichnis.
Internationale statistische Klassifikation der Krankheiten und verwandter Gesundheitsprobleme. 1. Aufl. Köln: Deutscher Ärzte-Verlag. 2014.
[12] Zaal IJ, Slooter AJ. Delirium in Critically Ill Patients. Drugs 2012;72:1457–71.
[13] Bounds M, Kram S, Speroni KG, Brice K, Luschinski MA, Harte S et al. Effect of ABCDE Bundle Implementation on Prevalence of Delirium in Intensive Care Unit Patients.
American journal of critical care an official publication, American Association Of Critical- Care Nurses 2016;25:535–44.
[14] Maldonado JR. Neuropathogenesis of delirium: review of current etiologic theories and common pathways. The American Journal Of Geriatric Psychiatry 2013;21:1190–222.
[15] Zhang Z, Pan L, Deng H, Ni H, Xu X. Prediction of delirium in critically ill patients with elevated C-reactive protein. Journal Of Critical Care 2014;29:88–92.
[16] Horacek R, Krnacova B, Prasko J, Latalova K. Delirium as a complication of the surgical intensive care. Neuropsychiatric Disease And Treatment 2016;12:2425–34.
[17] Smulter N, Lingehall HC, Gustafson Y, Olofsson B, Engström KG. Delirium after cardiac surgery: incidence and risk factors. Interactive cardiovascular and thoracic surgery 2013;17:790–6.
[18] Alazawi W, Pirmadjid N, Lahiri R, Bhattacharya S. Inflammatory and Immune Responses to Surgery and Their Clinical Impact. Annals Of Surgery 2016;264:73–80.
[19] Gentile LF, Cuenca AG, Efron PA, Ang D, Bihorac A, McKinley BA et al. Persistent inflammation and immunosuppression: a common syndrome and new horizon for surgical intensive care. The Journal Of Trauma And Acute Care Surgery 2012;72:1491–501.
[20] Vincent J. Update on surgical sepsis syndrome. The British Journal Of Surgery 2017;104:e34-e40.
[21] Pol RA, van Leeuwen, Barbara L., Izaks GJ, Reijnen MM, Visser L, Tielliu IF et al.
C-reactive Protein Predicts Postoperative Delirium Following Vascular Surgery. Annals Of Vascular Surgery 2014;28:1923–30.
[22] Gusmao-Flores D, Salluh, Jorge Ibrain Figueira, Chalhub R, Quarantini LC. The confusion assessment method for the intensive care unit (CAM-ICU) and intensive care delirium screening checklist (ICDSC) for the diagnosis of delirium: a systematic review and meta-analysis of clinical studies. Critical Care 2012;16:R115.
[23] Sessler CN, Gosnell MS, Grap MJ, Brophy GM, O'Neal PV, Keane KA et al. The Richmond Agitation-Sedation Scale: validity and reliability in adult intensive care unit patients. American Journal Of Respiratory And Critical Care Medicine 2002;166:1338–44.
[24] Ely EW, Girard TD, Shintani AK, Jackson JC, Gordon SM, Thomason, Jason W W et al. Apolipoprotein E4 polymorphism as a genetic predisposition to delirium in critically ill
patients. Critical Care Medicine 2007;35:112–7.
[25] Aldemir M, Ozen S, Kara IH, Sir A, Baç B. Predisposing factors for delirium in the surgical intensive care unit. Critical Care (London, England) 2001;5:265–70.
[26] Dubois MJ, Bergeron N, Dumont M, Dial S, Skrobik Y. Delirium in an intensive care unit: a study of risk factors. Intensive Care Med 2001;27:1297–304.
[27] Inouye SK. Precipitating Factors for Delirium in Hospitalized Elderly Persons. JAMA 1996;275:852.
[28] McNicoll L, Pisani MA, Zhang Y, Ely EW, Siegel MD, Inouye SK. Delirium in the intensive care unit: occurrence and clinical course in older patients. Journal Of The American Geriatrics Society 2003;51:591–8.
[29] Pandharipande P, Shintani A, Peterson J, Pun BT, Wilkinson GR, Dittus RS et al.
Lorazepam is an independent risk factor for transitioning to delirium in intensive care unit patients. Anesthesiology 2006;104:21–6.
[30] Schor JD, Levkoff SE, Lipsitz LA, Reilly CH, Cleary PD, Rowe JW et al. Risk factors for delirium in hospitalized elderly. JAMA 1992;267:827–31.
[31] Girard TD, Pandharipande PP, Ely EW. Delirium in the intensive care unit. Critical Care 2008;12:S3.
[32] Piva, Simone; McCreadie, Victoria A; Latronico, Nicola (2015): Neuroinflammation in sepsis: sepsis associated delirium. Cardiovasc Hematol Disord Drug Targets 15 (1), S. 10–
18. 2015.
[33] Mehta S, Cook D, Devlin JW, Skrobik Y, Meade M, Fergusson D et al. Prevalence, Risk Factors, and Outcomes of Delirium in Mechanically Ventilated Adults. Critical Care Medicine 2015;43:557–66.
[34] Tanaka R, Ishikawa H, Sato T, Shino M, Matsumoto T, Mori K et al. Incidence of Delirium Among Patients Having Cancer Injected With Different Opioids for the First Time.
The American Journal Of Hospice And Palliative Care 2016.
[35] Maddocks I, Somogyi A, Abbott F, Hayball P, Parker D. Attenuation of morphine- induced delirium in palliative care by substitution with infusion of oxycodone. Journal Of Pain And Symptom Management 1996;12:182–9.
[36] Ichai C, Vinsonneau C, Souweine B, Armando F, Canet E, Clec'h C et al. Acute kidney injury in the perioperative period and in intensive care units (excluding renal replacement therapies). Annals Of Intensive Care 2016;6:48.
[37] Hobson C, Ruchi R, Bihorac A. Perioperative Acute Kidney Injury: Risk Factors and
Predictive Strategies. Critical Care Clinics 2017;33:379–96.
[38] Siew ED, Fissell WH, Tripp CM, Blume JD, Wilson MD, Clark AJ et al. Acute Kidney Injury as a Risk Factor for Delirium and Coma during Critical Illness. American Journal Of Respiratory And Critical Care Medicine 2016.
[39] Baranyi A, Rothenhäusler H. The impact of intra- and postoperative albumin levels as a biomarker of delirium after cardiopulmonary bypass: results of an exploratory study.
Psychiatry Research 2012;200:957–63.
2. Publikation - Original
Quelle: http://austinpublishinggroup.com/criticalcare/fulltext/criticalcare-v4-id1021.php
3. Danksagung
An dieser Stelle möchte ich all den Personen danken, die mit Ihrer Unterstützung diese Arbeit erst möglich gemacht haben.
Zuallererst will ich mich bei meinem Doktorvater Prof. Thomas Bein bedanken, der mir jederzeit sowohl fachlich als auch menschlich mit Rat und Tat zur Seite gestanden hat und ohne dessen konstruktive Kritik, seine Ideen und seine Mithilfe diese Arbeit nicht zustande gekommen wäre. Es hat mir immer unglaublich viel Spaß gemacht, mit Dir
zusammenzuarbeiten und ich bin Dir für deine außergewöhnliche Unterstützung zu tiefstem Dank verpflichtet.
Ich danke den Pflegerinnen und Pflegern, den Ärztinnen und Ärzten und allen anderen Mitarbeitern auf Station 90 und 93, die mir die Datenerhebung unvorstellbar erleichtert, mich immer mit einem Lächeln empfangen und so meinen Arbeitsalltag außerordentlich verschönt haben.
Ferner bedanke ich mich bei meinem Bruder Dr. Andreas Zeder, an den ich mich bei der Erstellung der Arbeit jederzeit wenden konnte und der mir immer mit seiner konstruktiven Kritik behilflich war. Vielen Dank auch für die mehrfache Durchsicht meiner Arbeit.
Tief verbunden bin ich auch meinen Freunden aus dem Studium, insbesondere meiner Freundin Antonia. Ohne deren Unterstützung, Liebe und Freundschaft wären mein Studium und die Doktorarbeit nicht mit annähernd so viel Spaß verbunden gewesen. Außerdem konnte ich mich immer auf Eure Hilfe und Ratschläge verlassen.
Mein ganz besonderer Dank gilt meinen Eltern und Großeltern, die mich immer auf meinem Weg unterstützt, mir den Rücken freigehalten und mir meinen bisherigen Lebensweg
ermöglicht haben. Von Ihnen habe ich immer größten Rückhalt bekommen und Sie haben aus mir erst den Menschen gemacht, der ich bin. Euch widme ich diese Arbeit.
4. Lebenslauf
Marius Zeder
Geboren: 17.06.1992 in Erlangen Konfession: römisch-katholisch
Loewenichstr. 6a 91054 Erlangen Mobil: +49(0)157 84522332 E-Mail: marius_zeder@web.de
Studium und Schulbildung
10/2011 – 06/2018 Universitätsklinikum Regensburg Studium der Humanmedizin
Note des 3. Abschnitts der ärztlichen Prüfung: gut Note des 2. Abschnitts der ärztlichen Prüfung: gut Note des 1. Abschnitts der ärztlichen Prüfung: sehr gut 10/2014 - 02/2016 Universität Regensburg
Bachelor of Science in Betriebswirtschaftslehre (B.Sc.- ohne Abschluss)
09/2003 – 05/2011 Marie-Therese-Gymnasium Erlangen Allgemeine Hochschulreife
Abiturnote: 1.0 Klinische Erfahrung im Praktischen Jahr
12/2017 – 04/2018 3. Tertial des Praktischen Jahres
Urologische Klinik und Poliklinik, Klinikum der Universität München, Großhadern
10/2017 – 12/2017 2. Tertial des Praktischen Jahres
Klinik und Poliklinik für Chirurgie, Universitätsklinikum Regensburg
09/2017 – 10/2017 2.Tertial des Praktischen Jahres
Klinik für Allgemein- und Viszeralchirurgie, Karapitiya Teaching Hospital Galle, Sri Lanka
07/2017 – 09/2017 1.Tertial des Praktischen Jahres
Klinik und Poliklinik für Innere Medizin II,
Universitätsklinikum Regensburg, Kardiologie und Pneumologie
05/2017 – 07/2017 1.Tertial des Praktischen Jahres
Klinik und Poliklinik für Innere Medizin I, Universitätsklinikum Regensburg, Gastroenterologie, Endokrinologie und
Infektiologie Famulaturen
09/2016 –10/2016 Famulant
Praxis für Allgemeinmedizin Dr. Benedicter-Gmeiner und Dr.
Sattler Erlangen 08/2016 Famulant
Praxis für Orthopädie Dr. Zeder und Dr. Biwank, Eckental 03/2015 – 04/2015 Famulant
Urologische Klinik und Poliklinik, Klinikum der Universität München, Großhadern
09/2014 Famulant
Anästhesiologie, Waldkrankenhaus St. Marien, Erlangen Promotion
02/2015 – aktuell Frequency of Delirium in Non-Cardiac Surgical and Medical Intensive-Care Patients-Results from a
Comparative, Prospective, Observational Study (publiziert im Austin Critical Care Journal)
Prof. Dr. Thomas Bein Klinik für Anästhesiologie
Universitätsklinikum Regensburg
Anstellungen und Praktika
07/2015 – 06/2016 Studentische Hilfskraft
DACAPO-Studie zum schweren Lungenversagen, Prof. Dr.
Thomas Bein, Studienmitarbeit (Datenerfassung, Dateneingabe) 02/2014 – 03/2014 Studentische Hilfskraft
Lehrstuhl für Humananatomie und Embryologie, Prof. Dr. Ernst Tamm, Universität Regensburg, Tutor im Präparierkurs
04/2012 – 9/2012 Studentische Hilfskraft
Fakultät für Biologie und Vorklinische Medizin, Universität Regensburg, Tutor für Erstsemester
Fremdsprachenkenntnisse
Englisch fließend in Wort und Schrift
Latein Großes Latinum
Französisch gute Kenntnisse (B1 - Eurocentres Language School)
EDV-Kenntnisse Grundkenntnisse SPSS Statistiksoftware, Adobe Photoshop, Microsoft Office Paket
Auszeichnungen
10/2011 – 09/2018 Stipendiat im Max Weber Programm des Freistaates Bayern nach dem Bayerischen Eliteförderungsgesetz
05/2011 Biozukunftspreis der Stiftung „natur mensch kultur“
Engagement und Interessen
12/2014 – 12/2015 Gründungsmitglied und Vorsitzender des gemeinnützigen Vereins Medimeisterschaften Regensburg e.V.
Interessen Musik, Reisen, Sport