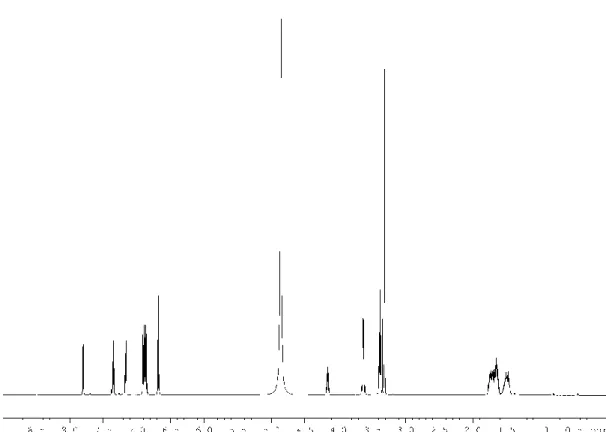
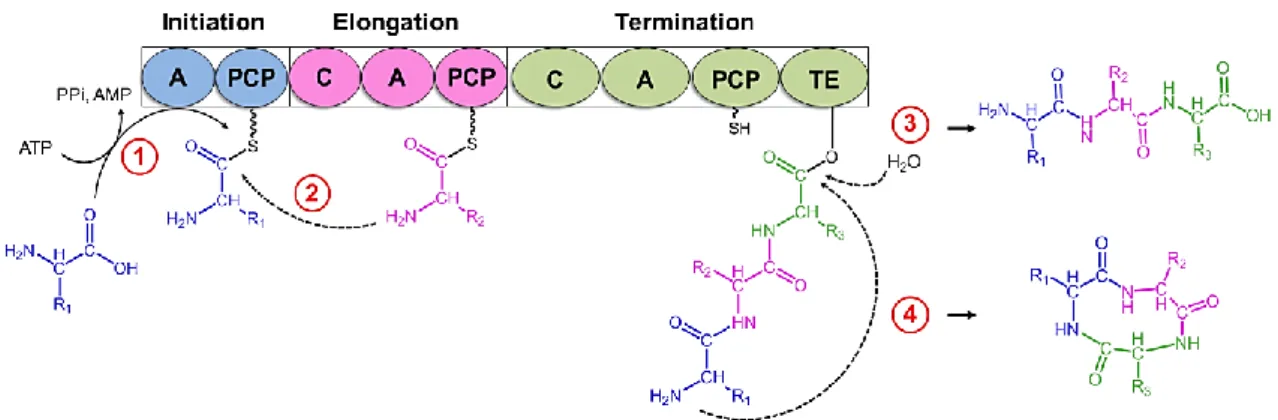
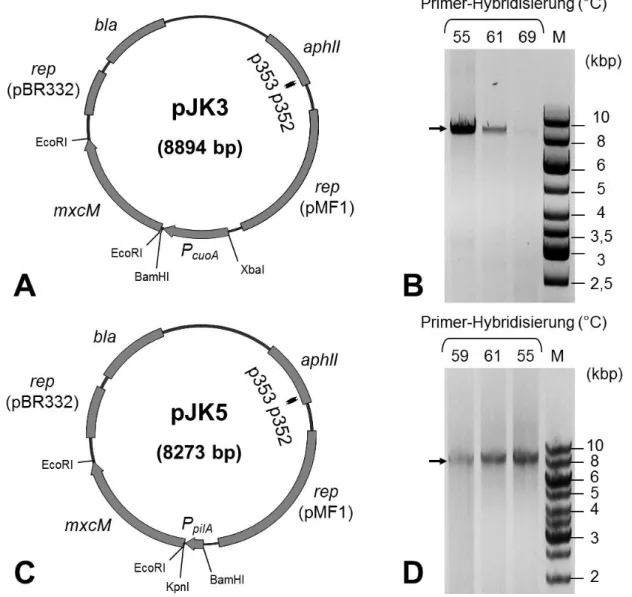
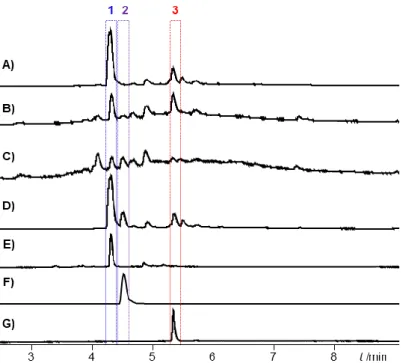
Untersuchungen zur Biosynthese und Funktion von Myxochelinen in Myxobakterien
Volltext
Abbildung

ÄHNLICHE DOKUMENTE
2.2 Aufklärung der Biosynthese von Chanoclavin-I in Aspergillus fumigatus durch biochemische Charakterisierung der Enzyme FgaCat und FgaOx1
So konnte in dem Collembola Folsomia candida eindeutig gezeigt werden, dass Hämocyanin eine Funktion in der Sauerstoffversorgung adulter Tiere übernimmt, wie sie
Da Galaktolipide bei Pflanzen und Blaualgen in großer Menge vorkommen, kann aber nicht eindeutig geklärt werden, ob einige der beobachteten Auswirkungen nur die
In diesem Pool findet der N-Stoffwechsel von Aminosäuren, Purin- bzw. Pyrimidin- derivaten und Ammonium statt. Zuflüsse stammen aus dem Futter- und MP-Abbau. Er
Auf den getesteten Lymphomzellen konnte für PDL1 eine überwiegend mittlere bis hohe Expression nachgewiesen werden.. Da PDL1 neben PDL2 ein weiterer Bindungspartner von
Sowohl nach Behandlung mit PI-PLC als auch nach Zerstörung des Membransystems durch Zugabe von Detergenz (0,1% Triton X-100, Abb. 30 C) zeigt sich an den permeabilisierten
EasG and FgaFS are key enzymes in the differentiation of ergot alkaloid biosynthesis in Claviceps purpurea and Aspergillus fumigatus.. Vortrag, Jahrestagung der
elongata AKB wurden optimiert, so dass mit der sich anschließenden Fermentation in einem 15 L Maßstab eine Basis für folgende Aufreinigungsprozesse zur Isolierung des