Übersicht Stabilität von Meßgrößen bei biologischen Proben
Stability of Quantities in Biological Samples
F. da Fonseca-Wollheim1·2
Zusammenfassung: Die Instabilität von Meßgrößen bei biologischen Proben stellt einen Unsicherheitsfak- tor dar, der innerhalb des Qualitätsmanagements ad- äquat berücksichtigt werden sollte. Ausgehend von ge- nauer gefaßten Definitionen der Begriffe Stabilität und Haltbarkeit werden in dem Beitrag mögliche Ursachen der Instabilität erörtert und klassifiziert. In Fällen mit ausgeprägter Instabilität können kausal verantwortli- che Einflußgrößen (z. B. in der Probenmatrix vorhan- dene Hydrolasen) identifiziert werden. Für die Erar- beitung von Haltbarkeitsangaben bezüglich einzelner Meßgrößen sind systematische Studien an zahlreichen·
Proben von Gesunden und Patienten unter Verwen- dung der in Frage kommenden Probengefäße und Ad- ditiva erforderlich. Als Beispiel werden Ergebnisse aus einer Studie bezüglich der Stabilität von Plasma-Am- moniak in Vollblutproben dargestellt. Aus der stati- stisch beschriebenen Instabilität läßt sich unter Be- rücksichtigung des nach medizinischen Kriterien maximal zulässigen analytischen Fehlers die Halt- barkeit der Proben ableiten. Die für Probentransport und -lagerung in einer Organisation angewendeten Be- dingungen müssen auf die Stabilität der Meßgrößen in der Probenmatrix abgestimmt sein.
Schlüsselwörter: Probenbehandlung; Zeitfaktoren;
Qualitätskontrolle.
Summary: The instability of measurable quantities in samples of biological origin is a source of uncertainty that should be considered-appropriately within quality management. Starting from more precise definitions of stability and maximum storage time, causes of instabi- lity are discussed and classified. In some cases of pro- nounced instability, causative influence factors (e.g., hydrolases contained in the sample matrix) can be identified. For the elaboration of stability specifica- tions regarding specified quantities, experimental stu- dies with numerous samples from healthy probands and patient groups are necessary. Such studies should include the appropriate sample containers and additi- ves. Furthermore the results should be evaluated stati- stically. As an example, stability studies regarding plasma ammonia concentration are presented. The ma-
1Zentral!aboratorium, Behring-Krankenhaus Berlin-Zehlendorf
2Korrespondenzadresse: Dr. med. Friedrich da Fonseca-Woll- heim, Behring-Krankenhaus, Zentrallaboratorium, Gimpelsteig 3-5. D-14165 Berlin. Fax: +49-30-8102-1909
Eingegangen: 20. September 1997-
ximum storage time of samples has to consider the limit analytical error, which depends on medical re- quirements. Conditions for transport and storage of samples within an organization have to be harmonized with the stability of the measurable quantities within the sample matrix.
Keywords: Specimen Handling; Time factors; Quali- ty control.
D
ie für das Fachgebiet Laboratoriumsmedizin wohl kennzeichnendste Tätigkeit besteht in der in vitro- Untersuchung von Proben hinsichtlich bestimmter medizinisch interessierender Eigenschaften („Meß- größen"). Proben sind dabei aufzufassen als Teile, die aus einem System entnommen wurden, um Informatio- nen über das System zu erhalten [1], Diese grundle- gende Definition führt zu der Forderung, daß die zu messenden bzw. zu bestimmenden Probeneigenschaf- ten zwischen Gewinnung der Primärprobe und Verar- beitung der „analytischen Portion" [1] unverändert bleiben. Bei Proben biologischen Ursprungs ist diese Forderung nur selten ideal erfüllt. Neben den durch das Analysenverfahren bedingten Fehlerkomponenten tra- gen damit in der präanalytischen Phase eintretende Veränderungen der Probe in wechselndem Umfang zur Unsicherheit der Ergebnisse bei. Die Frage der Stabi- lität von Meßgrößen bei biologischen Proben ist des- wegen eines der Kernprobleme der in vitro-Diagnostik.Überraschenderweise gibt es bisher keine in einer geltenden Norm niederlegte, für das Gebiet der Labo- ratoriumsmedizin adäquate Definition des Begriffs
„Probenstabilität". Eine Arbeitsgruppe der Deutschen Gesellschaft für Klinische Chemie und der Deutschen Gesellschaft für Laboratoriumsmedizin hat sich in jüngster Zeit dieses Themas angenommen und u. a.
auch Definitionsvorschläge für Stabilität und maxima- le Lagerungszeit unterbreitet [2]. Insgesamt kann bis- her von einer befriedigenden „Beherrschung" der durch die Instabilität der Meßgrößen bedingten Pro- bleme - etwa nach Art der statistischen Qualitätskon- trolle für die Analytik -, noch keine Rede sein.
Der vorliegende Beitrag will auf einige der vorhan- denen Problemfelder und sich ergebende Lösungsmög- lichkeiten aufmerksam machen. Wegen einer umfas- senderen Darstellung wird auf eine kürzlich erschiene- ne Monographie verwiesen [3].
601
Im einzelnen werden folgende Aspekte behandelt:
- Was bedeutet „Stabilität von Meßgrößen4*?
- Ursachen der Instabilität - Einflußgrößen der Instabilität
- Protokoll für die Gewinnung empirischer Stabi- litätsdaten
- Maximal zulässige Abweichungen durch Instabi- lität; Haltbarkeit
- Einsatz von speziellen Probengefäßen für instabile Meßgrößen?
- Festlegung von Bedingungen für Transport und La- gerung.
Stabilität von Meßgrößen
Nach einem von der International Federation of Clini- cal Chemistry vorgeschlagenen und auch in den Richt- linien der Bundesärztekammer [4] verwendeten Kon- zept werden heute diagnostisch relevante Probeneigen- schaften als Meίgrφίen definiert. Für ihre Beschrei- bung ist die „Trias"
- Analyt - System - Meßgrößenart
erforderlich. Zur Veranschaulichung sind einige Bei- spiele für die Charakterisierung von Meßgrößen nach diesem Konzept in Tabelle l wiedergegeben.
Eine eindeutig zu interpretierende Befünddarstel- lung umfaßt deswegen neben Analyt und System auch die Einheit, welche die Meßgrößenart erkennen läßt (z.
B. für die Angabe von Substanzmengenkonzen- trationen).
Wie die folgenden Beispiele zeigen, kann eine nur analytbezogene Diskussion des Begriffs Probenstabi- lität nicht alle hierbei auftretende Phänomene erklären:
a) Abnahme der Blut-Glukosekonzentration bei La- gerung von Vollblut in einem verschlossenen Proben- gefäß. Hierbei kommt es zu einer tatsächlichen Verminderung der Analytmenge in der Probe.
b) Zunahme der Na+-Konzentration nach Abfüllung von Plasma in ein offenes Probengefäß. Die Analyt- menge in der Probe nimmt nicht zu, aber die Verdamp- fung von Wasser führt zu einer Konzentrationszunah- me des Analyten.
c) Zunahme der K+-Konzentration im Plasma zu Lasten der intrazellulären K+-Konzentration bei Lage- rung von antikoaguliertem Vollblut. Es liegt lediglich eine Verschiebung von Ionen zwischen verschiedenen
Kompartimenten innerhalb der Probe vor, die Analyt- menge bleibt auch hier unverändert.
Es ist aus den Beispielen b) und c) ersichtlich, daß auch bei chemisch völlig stabilen Analyten Verände- rungen (=Instabilitäten) von Meßgrößen zu beobach- ten sind. Unabhängig von ihrer Ursache läßt sich jede während der Lagerung von Proben eintretende Ände- rung von Meßgrößen dem Phänomen „Instabilität" zu- ordnen.
Eine dieses Konzept berücksichtigende Definition des Begriffes „Probenstabilität" lautet [2]:
Probenstabilitδt: Fδhigkeit eines Probenmaterials, den initialen Wert einer Meίgrφίe unter festgelegten Lagerungsbedingungen όber eine definierte Zeit inner- halbfestgelegter Grenzen zu halten.
Der Begriff „Probenstabilität" setzt die Definition eines Stabilitätskriteriums voraus, d.h. die Festlegung einer maximal zulässigen Abweichung der Meßgröße vom initialen Wert auf Grund von Instabilität. Es ist auffällig, daß sehr häufig in der Literatur Angaben über Probenstabilität gemacht werden, ohne das ange- wendete Stabilitätskriterium überhaupt zu nennen.
•Hieraus ergeben sich z. T. erhebliche Divergenzen zwischen den mitgeteilten Haltbarkeiten.
Weiterhin ist es wichtig festzuhalten, daß Stabilität ein „qualitativer" Begriff ist, der nicht mit numeri- schen Werten zu beschreiben ist.
Neben dem Begriff „Probenstabilität" ist es sinn- voll, auch direkt von „Meßgrößenstabilität" zu spre- chen. Sie ist vorhanden, wenn der Wert der Meßgröße ausreichend konstant ist oder, genauer ausgedrückt, wenn vorgegebene maximale Abweichungen nicht über- oder unterschritten werden.
Die Instabilität von Meßgrößen läßt sich numerisch als Änderung ihres Wertes pro Zeiteinheit beschreiben.
Alternativ kann die Änderung des Wertes als absolute Differenz, als Quotient oder als Prozent-Wert (bezogen auf den initial vorhandenen Wert) ausgedrückt werden.
Für die Praxis wichtig ist vor allem der Begriff
„Haltbarkeit":
Die Haltbarkeit einer Probe ist die Dauer der Ver- wendbarkeit unter Einhaltung der zulδssigen Abwei- chungen der Meίgrφίe.
Falls der Wert einer Meßgröße bei einer Probe sich stetig mit bekannter Geschwindigkeit ändert, kann genau angegeben werden, wann die maximal zulässige Abweichung erreicht bzw. überschritten wird. Wegen der Variabilität biologischer Proben können jedoch verallgemeinernde Aussagen über die Haltbarkeit von
Tabelle 1 Beispiele für laboratoriumsmedizinische Meßgrößen Analyt
Natrium Glukose
Alaninaminotransferase Erythrozyten
System Plasma Blut Plasma Blut
Meßgrößenart ·
Substanzmengenkonzentration Massenkonzentration
Aktivitätskonzentration Partikelkonzentration
geeignete Einheit mmol/l
mg/dl · U/l Tera/l
Kurzbezeichnung P-Na (mmol/l) B-Glukose (mg/dl) P-ALAT (U/l)
B:Erythrozyten (Tera/l)
602 J Lab Med 1997; 21 (11): 601-606
F. da Fonseca-Wollheim: Stabilität von Meßgrößen bei biologischen Proben Proben bezüglich einer bestimmten Meßgröße nur
nach Untersuchung größerer Stichproben nach statisti- scher Datenauswertung getroffen werden.
Ursachen der Instabilität
Für das kausale Verständnis der Instabilität von Meß- größen bei biologischen Proben wird im Folgenden versucht, eine Gliederung nach Ursachen zu geben.
Prozesse mit Abnahme der Analytmenge im geschlos- senen System
Sehr häufig läßt sich die Instabilität einer Meßgröße auf die bei Lagerung eintretende Abnahme der Menge des Analyten in der Probe zurückführen. Bezogen auf die jeweils in Parenthese genannten Systeme können als Beispiele erwähnt werden: Glukose (Vollblut), Saure Phosphatase-Aktivität (Serum), Gerinnungs- faktor VIII-Aktivität (Plasma), Calcium (Urin), Leu- kozytenzahl (Urin), Zellzahl (Liquor cerebrospinalis).
Die zugrunde liegenden Prozesse können chemischer Natur sein (z, B. enzymatische oder nicht-enzymati- sche Hydrolysen und Oxidationen) oder physikalisch (z. B. Ausfällung schwerlöslicher Substanzen bei un- physiologisch niedriger Temperatur, Lyse von Zellen im hypotonen Milieu) bedingt sein.
Prozesse mit Zunahme der Analytmenge im geschlos- senen System
Eine weitere wichtige Ursache für Instabilität von Meßgrößen sind chemische Umwandlungen von sog.
Präkursoren, welche die Menge des Analyten in der Probe erhφhen. Hierdurch potentiell verfälschte Meß- größen .(Präkursoren in Parenthese) sind z. B. Plasma- Laktat (Glukose), Plasma-Ammoniak (Adenosinmono- phosphat, Glutamin), Plasma-Glycerol (Triglyceride), Plasma-Phosphat (Phosphorsäureester), freie Fettsäu- ren (Lipide), Osmolalität (Glukose), CO2 (Glukose) und H+ (Glukose). Durch Fragmentierung von Blutzel- len kann die durch Impedanzmessung als Blutplätt- chen erfaßte Partikelzahl, fälschlich erhöht gefunden werden.
Bindungsphänomene; Elektrolyt-Shifts zwischen Korn- partimenten
Für Bindungsphänomene bei Ionen und Elektrolyts- hifts zwischen getrennten Flüssigkeitsräumen gibt es einige wichtige Beispiele:
Die Aktivität von Ca^-Ionen ist u.a. vom pH-Wert der Probe abhängig, der die Proteinbindung beeinflußt.
Alkalisierung der Probe, z. B.· durch CCVVerlust, ver- mindert deswegen die zu messende Ca++-Aktivität, während eine pH-Senkung den gegenteiligen Effekt hat.Die Verteilung der Ionen NHf und Cl' zwischen intra- und extrazellulärem Kompartment hängt vom pH-Wert der Probe ab. Bei Lagerung von Blutproben eintretende pH-Verminderungen führen deswegen zur Abnahme der Cl-Konzentration und zur Zunahme von
NH4+ im Plasma-Kompartment, während eine Alka- lisierung infolge CO2-Verlust umgekehrte Effekte her- vorruft.
Instabilität durch Abflachung der Konzentrationsgra- dienten zwischen intra- und extrazellulärem Blutkom- partment
Bei Lagerung von Blutproben kommt es infolge Ab- flachung der physiologisch durch aktive Stoffwechsel- vorgänge aufrecht erhaltenen Konzentrationsgradien- ten zwischen intra- und extrazellulärem Raum bei K+
und Na+ zur Zu- bzw. Abnahme der im Plasma zu mes- senden Werte.
Ähnlich wirkt sich eine ablaufende Hämolyse aus.
Sie betrifft zusätzlich auch die passiv von der Erythro- zytenmembran zurückgehaltenen, intrazellulär hoch angereicherten Bestandteile wie Hämoglobin, Saure Phosphatase und Laktatdehydrogenase.
Gasdiffusion
Sofern Laborproben nicht im geschlossenen System gehalten werden, findet bei Meßgrößen mit gasförmi- gen Analyten (CO2, 02) ein Austausch entsprechend dem Konzentrationsgradienten statt.
Für NH3 ist die Probenkontamination durch ammo- niakreiche Raumluft, insbesondere Zigarettenrauch, beschrieben worden [5]. Mit einer Verlustmöglichkeit von NHa aus der Probe in die atmosphärische Luft ist dagegen wegen des hohen pKa-Weites (weit überwie- gende Bildung von NH^-Ionen) und der guten Wasserlöslichkeit bei physiologischem pH nicht zu rechnen.
Einflußgrößen der Stabilität
Für einige Meßgrößen sind Einflußgrößen bekannt, die bei biologischen Proben die Instabilität erhöhen (Ta- belle 2). Bei bekanntem Mechanismus ist es möglich, gezielte Maßnahmen zur Stabilisierung (z. B. Einsatz von Enzymhemmstoffen, pH-Veränderung, Licht- schutz) zu ergreifen: Wichtig sind Einflußgrößen, die nur unter pathologischen Bedingungen die Instabilität der Meßgröße in störendem Umfang vergrößern und zu klinisch relevanten Verfälschungen führen können.
Ein interessantes Beispiel einer solchen Einflußgröße ist die -GT-Aktivität in Bezug auf die Meßgröße Plasma-Ammoniakkonzentration. Bei Aktivitäten im Referenzbereich ist nur ein schwacher Zusammenhang zwischen der Instabilität von Plasmaproben und der - GT Aktivität erkennbar. Bei Hepatopathien mit stark erhöhten -GT-Aktivitäten ist im Plasma eine so hohe Glutaminase-Aktivität vorhanden, daß die Haltbarkeit von Plasma bei Raumtemperatur auf wenige Minuten beschränkt ist und die Verwendung eines spezifischen Inhibitorgemischs indiziert erscheint [9]. Derartige Einflußgrößen müssen beim „Probenhandling" oder spätestens bei der Plausibilitätsprüfung vor Freigabe der Befunde berücksichtigt werden.
Tabelle 2 Beispiele für identifizierte Einflußgrößen der Probenstabilität
Einflußgröße Erhöhte Instabilität von Mechanismus Leukozytenzahl
Uchteinwirkung Thrombozytenzahl
-Glutarnyltransferase-AktivJtät Phosphatase-Aktivität Erythrozytenzahl
B-Glukose
P-Bilirubin, P-Creatinkinase, S-Folsäure, U-Porphyrine P-Kalium, P-LDH, P-Phosphat P-Ammoniak
P-Phosphat B-Ammoniak
Glykolyse [6]
Photooxidation [7]
Freisetzung aus Thrombozyten [8]
Glutamin -> Glutaminsäure + NHa [9]
Phosphatester-Spaltung [8]
Adenosinmonophosphat-Desaminierung [10,11]
Protokoll für die Gewinnung empirischer Stabilitätsdaten
Das Ziel bei der empirischen Ermittlung von Stabi- litätsdaten ist es, eine genügend große Datenbasis für eine statistisch abgesicherte Definition der Proben- haltbarkeit zu erhalten. Obwohl in der Literatur in großer Zahl Beobachtungen über die Stabilität von Meßgrößen publiziert sind [12], genügen die bisher verfügbaren Literaturangaben wegen der oft nur klei- nen Anzahl untersuchter Proben nur selten diesem An- spruch.
Folgende Informationen sind notwendig bzw. wün- schenswert:
- Charakterisierung des Probandenkollektivs (Anzahl;
Gesunde/Patienten; Alter; Geschlecht; Rasse) - Präanalytische Bedingungen (Tageszeit; nüchtern/
nicht nüchtern; Körperlage; Körperliche Aktivität;
Technik der Probenahme; entnommenes Proben- volumen)
- Additiva (Antikoagulantien, Stabilisatoren), molare Konzentrationen
- Laborprobengefäße (Hersteller, Material, Abmes- sungen)
- Probenlagerung/-aufarbeitung (Angaben über Zeit- und Temperaturbedingungen, offene/verschlossene Gefäße; Lichteinwirkung, mechanische Einwir- kung).
- Zentrifugationsbedingungen (g-Zahl, Dauer, Tem- peratur)
- Separierhilfen (Gel, Filter)
- Benutztes analytisches System/Analysenverfahren, während der Studie ermittelte Präzision und Rich- tigkeit mit Kontrollproben
- Grafische oder tabellarische Darstellung der beob- achteten Veränderungen der Meßgrößen pro Zeitin- tervall mit Angaben von x, s, Mediän, Perzentilwer- ten, spezifiziert für
- unterschiedliche Antikoagulantien und sonstige Additiva
- Laborproben und gegebenenfalls daraus gewon- nene analytische Proben, z. B. Vollblut und Plas- ma/Serum)
- unterschiedliche Lagerungstemperaturen, soweit anwendbar (z. B. 20-25 °C, 2-6 °C, -20 °C , ge- gebenenfalls auch tiefere Temperaturen).
Das Studium der Probenstabilität sollte neben ge- sunden Probanden auch ein größeres Kollektiv von Pa- tienten umfassen, da bei abnorm veränderter Proben- matrix unter Umständen mit schlechterer Stabilitäten zu rechnen ist [9].
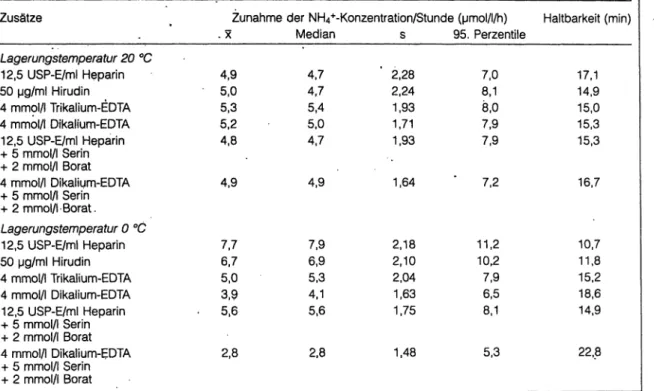
Exemplarisch sind in Tabelle 3 Stabilitätsdaten für Plasma-Ammoniak bei Lagerung von jeweils 51 Voll- blutproben von gesunden, nicht nüchternen Probanden gezeigt. Die Stabilitätsmessungen wurden parallel mit unterschiedlichen Antikoagulantien, teilweise auch in Kombination mit einem Stabilisatorgemisch zur Inhi- bierung der Plasma-Glutaminase-Aktivität [9], durch- geführt. Untersucht wurde der linear erfolgende An- stieg der Ammoniakkonzentration [11] während einer 90-minütigen Inkubationsperiode in verschlossenen Gefäßen. Die Ammoniakbestimmungen erfolgten mit einem enzymatischen Meßverfahren [11], das bei der Präzisionskontrolle in der Serie einen Variationskoeffi- zienten von 1,6% aufwies. Die mittlere Abweichung vom Zielwert wässriger Richtigkeitskontrollproben (Preciset Ammoniak, Boehringer Mannheim GmbH) betrug -1,3%.
Maximal zulässige Abweichungen durch Instabilität; Haltbarkeit
Die durch Instabilität der Meßgröße bewirkten präana- lytischen Veränderungen wirken sich als systemati- scher Fehler (Bias) aus. Systematische Fehler sollen die Größenordnung von 1/12 des biologischen Refe- renzintervalls nicht überschreiten, da sonst der Anteil falsch positiver/negativer klinischer Klassifizierungen des Befunds intolerabel ansteigt [13]. Dieses Kriteri- um liegt auch den Richtlinien der Bundesärztekammer zugrunde [4]. Es wurde deswegen vorgeschlagen, 1/12 des biologischen Referenzintervalls als Stabilitätskri- terium zugrunde zu legen [2,11]. Um einen stabilitäts- bedingten systematischen Fehler in dieser Größenord- nung nur selten zuzulassen, wurde als Haltbarkeit die Zeit definiert, bei der das Stabilitätskriterium von 95%
der Proben nicht überschritten wird [2].
Beispiel: Der Referenzbereich für die Ammoniak- konzentration im venösen Plasma beträgt 11- 35
/ [14 ], das Referenzintervall somit 24 (umol/l.
604 J Lab Med 1997; 21 (11): 601-606
F. da Fonseca-Wollheim: Stabilität von Meßgrößen bei biologischen Proben
Tabelle 3 Zunahme der NH4+-Konzentration im Plasma bei anaerober Lagerung von Vollblut mit verschiedenen Zu- sätzen. Untersucht wurden Proben von 51 gesunden Personen. Bei Annahme einer maximal zulässigen Abweichung von +2 / ergeben sich die in der letzten Spalte gezeigten Haltbarkeiten für Vollblutproben.
Zusätze
Lagerungstemperatur 20 °C 12,5 USP-E/ml Heparin 50 Mg/ml Hirudin 4 mmol/l Trikalium-EDTA 4 mmol/l Dikalium-EDTA 12,5 USP-E/ml Heparin + 5 mmol/l Serin + 2 mmol/l Borat 4 mmol/l Dikalium-EDTA + 5 mmol/l Serin + 2 mmol/l Borat.
Lagerungstemperatur 0 °C 12,5 USP-E/ml Heparin 50 pg/ml Hirudin 4 mmol/l Trikalium-EDTA 4 mmol/l Dikalium-EDTA 12,5 USP-E/ml Heparin + 5 mmol/l Serin + 2 mmol/l Borat 4 mmol/l Dikalium-EDTA + 5 mmol/l Serin + 2 mmol/l Borat
Zunahme der NH4+-Konzentration/Stunde (pmol/l/h) . Mediän s 95. Perzentile
4,9 5,0 5,3 5,2 4,8
4,9
7,7 6,7 5,0 3,9 . 5,6
2,8
4,7 4,7 5,4 5,0 4,7
4,9
7,9 6,9 5,3 4,1 5,6
2,8
2,28 2,24 1,93 1,71 1,93
1,64
2,18 2,10 2,04 1,63 1,75
1,48
7,0 8,1 8,0 7,9 7,9
7,2
11,2 10,2 7,9 6,5 8,1
5,3
Haltbarkeit (min)
17,1 14,9 15,0 15,3 15,3
16,7
10,7 11,8 15,2 18,6 14,9
22,8
1/12 des biologischen Referenzintervalls = maximal zulässige analytische Impräzision = maximal zulässige präanalytische Abweichung = 2 / .
Die durchschnittliche Bildungsrate von P-Ammoni- ak in antikoaguliertem Vollblut (EDTA-Trikalium- Salz, 4 mmol/l) bei 0 °C (Eisbad) beträgt 5;3 /1/h, s = 2,04 /1/h. Unter Berücksichtigung der für die 95. Perzentile gefundenen Ammoniakbildungsrate (7,9 /l/h) errechnet sich als Haltbarkeit 60 2/7,9 min
= 15,2 min. Bei einer Transport-TLagerungszeit von ca.
15 min wird demnach das Stabilitätskriterium von 95% der Proben eing'ehalten.
Weiterhin ist aus den gezeigten Daten ersichtlich, daß die Art des Antikoagulanz und weitere Zusätze die Haltbarkeit beeinflussen. Die bessere Stabilität mit Dikalium-EDTA läßt sich leider nicht nutzen, weil es.
eine pH-Senkung und damit einen Shift von zel- lulärem Ammoniak in das Plasma bewirkt (s.o.). Die bei pathologischen Proben mit erhöhter -GT-Aktivität sehr effektive Stabilisierung von Blut- und Plasmapro- ben durch Serin-Borät [9] ist bei Blutproben von Ge- sunden nur schwach ausgeprägt. Auffällig ist die deut- lich schlechtere Stabilität mit Heparin und Hirudin bei 0 °C gegenüber 20 °C. Auf eine Kühlung der Probe sollte jedoch nicht verzichtet werden, weil bei höheren Umgebungstemperaturen (oberhalb von 20 °C) die Ammoniakbildungsrate sehr stark zunimmt [11].
Das gezeigte Beispiel betrifft eine Meßgröße, die für ihre Instabilität bekannt ist und bei der die potenti- ellen Veränderungen bei Lagerung im Vergleich zu anderen Meßgrößen besonders hoch sind [8]. Jedoch werden auch für andere, häufig bestimmte Meßgrößen nur kurze Zeitspannen angegeben, innerhalb derer die Stabilität noch gewährleistet ist, z. B. 10 min für Blut- Glukose (nicht stabilisiertes Vollblut bei Raumtempe- ratur) und 15 min für Blutgase (ohne Kühlung, Plastik- Probengefäße) [3]. Bei einer Reihe sorgfältig hinsicht- lich der Stabilität untersuchter klinisch-chemischer Serum-Meßgrößen hat sich auf der anderen Seite ge- zeigt, daß ihre Haltbarkeit nach Abtrennung der Blut- zellen bei Kühlschranklagerung mindestens 7 Tage be- trägt und in vielen Fällen entscheidend besser als im Vollblut ist. [15]. Allerdings muß grundsätzlich mit der Möglichkeit gerechnet werden, daß bei Proben von Pa- tienten die Stabilität schlechter ist als nach den Unter- suchungen bei Gesunden zu erwarten. Bei einem Screening an EDTA-Plasmen aus der klinischen Rou- tine fanden sich bei 10% der Proben im Vergleich zu den Proben eines Normalkollektivs höhere Ammo- niakbildungsraten, was letztendlich auf die Glutami- nasewirkung von erhöhter -GT-Aktivität zurück- geführt werden konnte [9]. Entsprechende Untersu- chungen für andere Meßgrößen stehen noch aus.
Eine unübersichtliche Situation liegt bei durch- flußzytometrischen Blutzellzählungen und -typisierun- 605
gen vor. weil je nach Meßverfahren und Auswertungs- Software unterschiedliche Instabilitäten der Meß- größen (z. B. Blut-Monozytenkonzentratlon) gefunden werden. Entsprechend dem raschen technologischen Fortschritt auf diesem Gebiet müssen die vom Meß- systcm abhängigen Haltbarkeitsangaben ständig revi- diert werden.
Einsatz von speziellen Probengefäßen für instabile Meßgrößen?
Für die Herstellung von Laborproben werden Additiva benötigt, die je nach Verwendungszweck gerinnungs- hemmend/-fördernd wirken oder bestimmte Meß- größen stabilisieren sollen (z. B. Natriumfluorid für Blut-Glukose und Plasma-Laktat).
Allein wegen des Aufwandes für die Evaluation neuer Untersuchungsverfahren und der in diesem Zu- sammenhang zu fordernden sorgfältigen Untersuchun- gen bezüglich der Meßgrößenstabilität in der Proben ist eine Standardisierung der Additiva anzustreben und die Zahl spezifisch präparierter Probengefäße mög- lichst gering zu halten. Die Beschränkung auf mög- lichst wenige Laborprobenarten wird auch von den Routinelaboratorien und den Einsendern aus verschie- denen Gründen gewünscht. Die deshalb häufig aufge- worfene Frage, ob entgegen dieser Tendenz für spezi- elle Meßgrößen gesonderte, mit spezifischen Additiva präparierte Probengefäße (z. B. für hämostaseologi- sche SpezialUntersuchungen) in einer Institution einge- führt werden mόssen, läßt sich objektiv beantworten, indem wie oben gezeigt die- Haltbarkeit ohne Stabili- sator ermittelt und mit der in einer gegebenen räumli- chen und organisatorischen Situation unvermeidlichen Transport- und Lagerungszeit verglichen wird.
Festlegung der Bedingungen für Trans- port und Lagerung von Proben
Aus den verfügbaren Stabilitätsdaten der einzelnen Meßgrößen ergeben sich Anforderungen hinsichtlich der in der präanalytischen Phase einzuhaltenden Be- dingungen (zu verwendende Probengefäße einschließ- lich Zusätze, maximale Lagerungs-TTransportzeit, Temperatur). Bei längeren Transportwegen kann es
notwendig sein, eine Vorverarbeitung der Proben (z. B.
Zentrifugal ion von Blutproben) zu fordern. Die Be- schreibung dieser Abläufe als Teil der sog. präanalyti- schen Prozeduren bildet ein wichtiges Element des Qualitätsmanagements [16]. Um eine Überwachungs- möglichkeit zu haben, sollten bei Laboraufträgen, ins- besondere bei instabilen Meßgrößen, die Zeitpunkte der Probenahme und des Eingangs der Probe im Labo- ratorium festgehalten werden [2].
Literatur
1. European Committee for Standardization. In vitro diagnostic medical devices - Measurement of quantities in samples of biologi- cal origin - Presentation of reference measurement procedures, pr EN 12286, 1997.
2. Guder WG, da Fonseca-Wollheim F, Heil W, Müller-Plathe O, Töpfer G, Wisser H, Zawta B. Stabilität der Meßgröße in der Ma- trix. DG Klinische Chemie Mitteilungen 1995:26:205-9.
3. Guder WG, Narayanan S, Wisser H, Zawta B. Samples: From tthe patient to the laboratory. The impact of preanalytical variables on the quality of laboratory results. Darmstadt (DE): GIT-Verlag, 1996.
4. Richtlinien der Bundesärztekammer zur Qualitätssicherung in medizinischen Laboratorien. Dtsch Ärztebl 1988;85:A697~712.
5. Gerron GG, Ansley JD, Isaacs JW, Kutner MH, Rudman D.
Technical pitfalls in measurement of venous plasma NHa concen- tration. Clin Chem 1976;22:663-6.
6. Salway JG. Drug-test interactions handbbook. London (UK):
Chapman and Hall, 1990.
7. Keller H. Klinisch-chemische Labordiagnostik für die Praxis. 2, Auflage. Stuttgart (DE): Thieme, 1991.
8. Voit R. Plasma-Serum-Unterschiede und Lagerungsstabilität klinisch-chemischer Meßgrößen bei Verwendung von Plasma-Röhr- chen. Dissertation München, 1993.
9. da Fonseca-Woilheim F. Deamidation of glutamine by increa- sed -glutamyltransferase is a source of rapid ammonia formation in blood and plasma specimens..Clin Chem 1990;36:1479-82.
10. Rapoport I, Drang I, Rapoport SM. Catabolism of adenine nucleotides in rabbit blood cells. Biomed Biochim Acta
1990;49:ll-6.
11. da Fonseca-Wollheim F. Preanalytical increase of ammonia in blood specimens of healthy subjects. Clin Chem 1990;36:1483-7.
12. Young DS. Effects of preanalytical variables on clinical labora- tory tests. Washington (USA): AACC Press, 1993.
13. Stamm D. Medizinische Erfordernisse für klinisch-chemische Untersuchungen. In: Greiling H, Gressner AM, editors. Lehrbuch der klinischen Chemie und Pathobiochemie, 3. Auflage. Stuttgart (DE): Schattauer, 1995,92.
14. Tietz NW, editor. Clinical guide to laboratory tests. Philadel- phia (USA):WB Saunders Co, 1983.
15. Heins M, Heil W, Withold W. Storage of serum or whole blood samples? Effects of time and temperature on 22 serum analytes. Eur J Clin Chem Clin Biochem 1995;33:231-8.
16. International Organization for Standardization. Quality Mana- gement in the Clinical Laboratory (Draft). 1997.
606 J Lab Med 1997; 21 (11): 601-606
þ··--.;.·^.^·'-·''·.·. -""í· • i·'··***::,
; #! bWv-?$&
^#·- '*·'·' '- .;·: ·.._·; ·"—· >.'._: .ô ·.Λ· ¢···-·, í., ^••^-/^,^.ô'