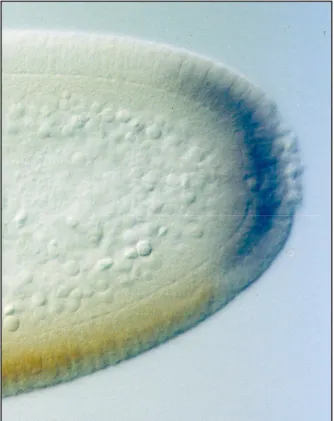
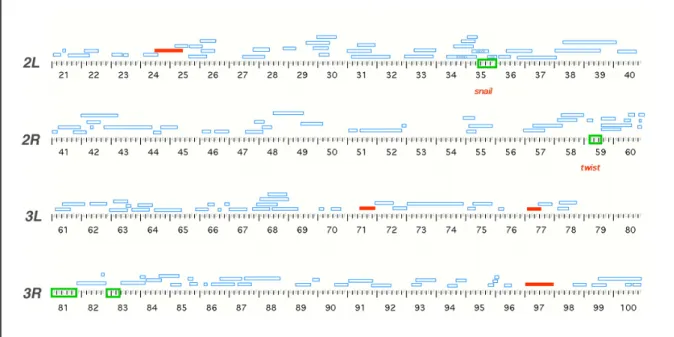
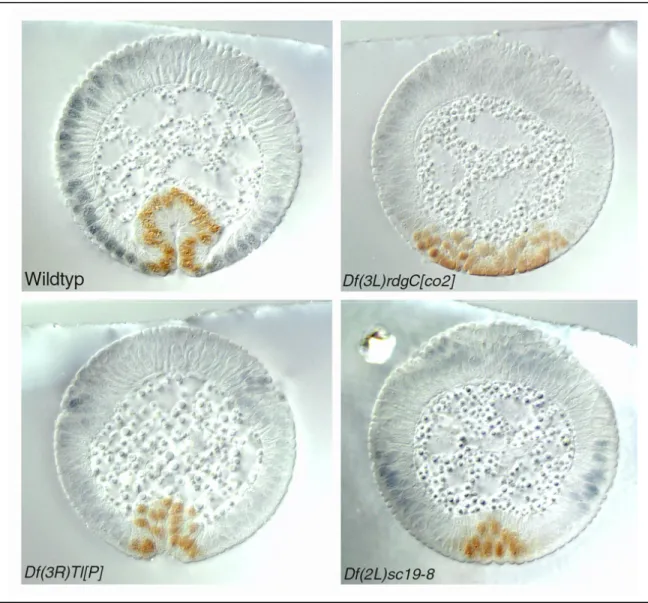
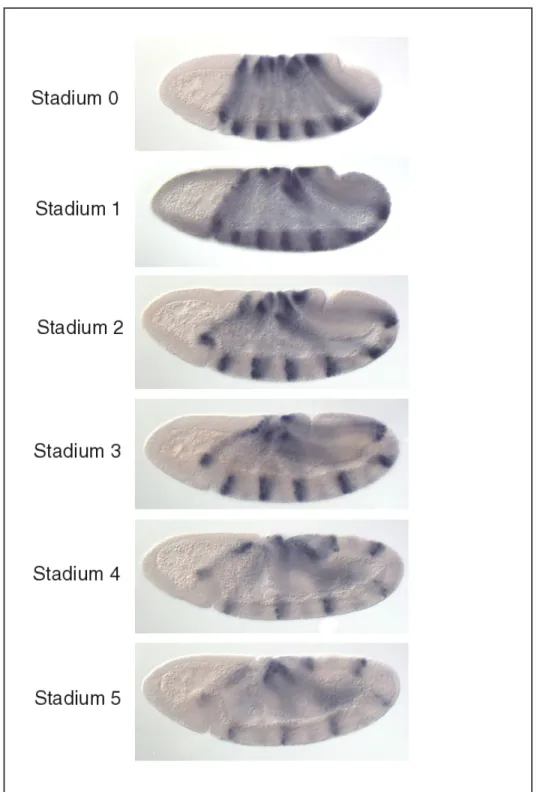
Untersuchungen zur genetischen Kontrolle der Gastrulation von Drosophila melanogaster
Volltext
Abbildung


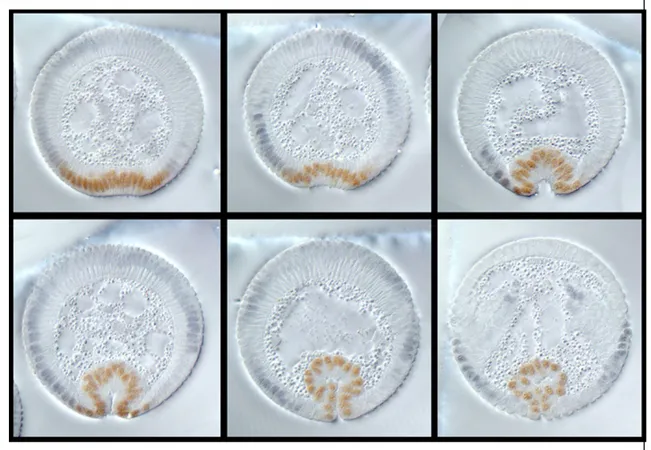
ÄHNLICHE DOKUMENTE
Diese Daten zeigen, dass eine veränderte Wechselwirkung von AdoMet und AdoHcy mit SU(VAR)3-9 13 als Ursache für die verringerte KMTase-Aktivität ausgeschlossen werden kann..
PU15-404 forward ATACCCGGGAATTTTTAATAATTTCTTTTTATGTT 3 hybrid snRNA:7SK:94F (15-404nts) PU15-404 AS AATCCCGGGAAAATAAAACCCAGACTGCCC 3 hybrid snRNA:7SK:94F (15-404nts) PU15-163
After the population reproduces the complete Hi-C data, we include the vector E (lamina- DamID), again in stages with decreasing contact probability thresholds (λ).... Snapshot of
Sensation of noxious cold in the larvae appears to be mediated by class III multidendritic (md) neurons, located in the body wall, which require the TRP channels NompC, Trpm and Amo
Während der Mitose durchläuft die Zelle große morphologische Veränderungen. Dabei werden die beiden Schwesterchromatiden über Cohesine
Jedoch zeigte eine spezifische Markierung der R1-R6 Axone in larvalen hdc 50 -Mutanten (Abb. 27), dass diese PRA fast alle korrekt in der Lamina halten und nicht in die Medulla
Bypassing was first identified in the translation of the gene 60 of bacteriophage T4 (Huang et al., 1988; Weiss et al., 1990), where the ribosome translates the mRNA until it
Die Befallsstärke bildet die eigentliche Relevanz des Erregers, da durch den Verlust der assimilierenden Blattfläche der Ertrag zurückgeht. Die Untersuchungen zeigen, dass die