Einleitung
Bei Verletzungen im peripheren Nervensystem (PNS) können sowohl die Axone als auch die Schwannzellen mit der von ihr gebildeten Myelinscheide geschädigt werden. Die Schwere der Schädigung wird nach Sunderland [25] in fünf Gradstufen unterteilt. Eine wesentliche Vorrausetzung für die Regeneration peripherer Nerven ist ein multifaktorielles und geregeltes Zu-
sammenspiel zwischen Nervenzellen, Schwannzellen, Makro- phagen, Wachstumsfaktoren und dem Zielorgan (Abb. 1).
Erste Ansätze zur operativen Wiederherstellung von periphe- ren Nervendefekten wurden schon im zweiten Jahrhundert n. Chr. von Galen beschrieben [26]. Erste Ideen zur Entwicklung einer entsprechenden Nervenprothese hat die rekonstruktive Chirurgie bereits seit der vorletzten Jahrhundertwende be- schäftigt [24]. Insbesondere die wissenschaftlichen Arbeiten von Millesi [19] und Samii [22], über die Bedeutung von mikro- chirurgischen Nahttechniken, waren Meilensteine in der Chir- urgie der peripheren Nerven [24].
Die Überbrückung von Defektstrecken bis zu einem Zentime- ter spielen im klinischen Alltag keine wesentliche Rolle, wo- hingegen längere Defektstrecken eines Interponates bedürfen.
Autoren:Bozkurt A1*, Smeets R2*, Lassner F1, Wöltje M2, Sri Harwoko M3, Shen ZL4, Tank J1, Beckmann Ch1, Gries T3, Pallua N1
Schlagworte:Schwann- zellen – periphere Ner- venregeneration – PLA – PGA
Keywords: Schwann cells – peripheral nerve regeneration – nerve conduit – PLA – PGA Zitierweise dieses Bei- trages: BIOmaterialien 2006; 7 (2) S. 74-81
Periphere Nervendefekte treten häufig als Folge von Verletzungen auf und führen zu motorischen und sensiblen Ausfällen. Neben der primären Nervennaht und der autologen Nerventransplantation (z.B.
Nervus suralis) stehen bei peripheren Nervendefekten keine erfolg- reichen Therapien zur Verfügung. Zusätzlich zum Hebedefekt an der Entnahmestelle ist die autologe Nerventransplantation v. a. durch die begrenzte Anzahl und Durchmesser der Spendernerven limitiert.
Bioartifizielle Nerveninterponate, besiedelt mit autologen Zellen, könnten hier Abhilfe schaffen.
Inhalt der vorliegenden Arbeit sind erste in-vitro Ergebnisse bei der Entwicklung einer synthetischen Nervenleitschiene aus resorbierba- rem Polyglycolid (PGA) und Polylactid (PLA) in Verbindung mit ei- nem Zellträger aus Fibringel und Schwannzellen. Licht- und Fluores- zenzmikroskopisch zeigte die Schwannzellkultur einen hohen Rein- heitsgehalt mit typischer Morphologie mit spitz-ovalären Zellsomata und bipolaren Zellausläufern. Unterschiedliche Verfahren (Trypan- blaufärbung, XTT-Test, Fluoreszein-Diacetat [FDA] & Propidium-Jo- did [PI]) zeigten im Verlauf eine anhaltend hohe Vitalität der Schwannzellen in der Thrombinkomponente. Dies gilt als Vorausset- zung für den nächsten Schritt, den hier skizzierten Verbundwerkstoff bestehend aus Fibringel und Schwannzellen bzw. dem Epineurium- ersatz aus PLA und PGA im Tiermodell zu erproben und das regene- rative Potential zu untersuchen.
using a resorbable PLA and PGA tube filled with fibrin gel and Schwann cells
1) Klinik für Plastische, Hand- und Verbrennungschirurgie; Universitätsklinikum der RWTH Aachen
2) Interdisziplinäres Zentrum für klinische Forschung „BioMAT.“; Universitätsklini- kum Aachen; in der Medizinischen Fakultät der RWTH Aachen
3) Institut für Textiltechnik der RWTH Aachen
4) Department of Plastic Surgery, Shanghai First People’s Hospital, Shanhai Jiao Tong Univesity, Shanhai, China
* Beide Autoren sind Erstautoren.
Goldstandard in der klinischen Anwendung ist die mittlerwei- le etablierte Methode, periphere Nervendefekte durch mikro- chirurgische Transplantation körpereigener Nerven zu rekon- struieren [24, 19, 22]. Als Nerventransplantate dienen heute vor allem der Nervus (N.) suralis, aber auch der N. cutaneus antebrachii medialis und der N. cutaneus femoris lateralis.
Nachteil der autologen Nerventransplantation sind Hebede- fekte, wie z. B. der Sensibilitätsausfall oder Neuromschmer- zen an der Entnahmestelle. Insbesondere stehen jedoch für große Nervendefekte in vielen Fällen nicht ausreichend kör- pereigenes Transplantatmaterial zur Verfügung, um die De- fektstrecke und/oder die gesamte Querschnittsfläche der Ner- venstümpfe abdecken zu können [24]. Die Entwicklung von Nervenprothesen ist deshalb schon seit langer Zeit in den Fo- kus der klinisch orientierten Forschung gerückt.
Für die Überbrückung peripherer Nervendefekte wurden schon künstliche Interponate verwendet, bevor die Techniken der Nerventransplantation etabliert waren. Es existiert eine Vielzahl an Forschungsansätzen, die sich mit dem Thema der Defekt- überbrückung peripherer Nerven durch geeignete Leitschienen
kenntnis, dass zellbesiedelte Bioträger den azellulären Ner- veninterponaten überlegen sind. Dies beruht vor allem auf den Schwannzellen, die neben einer Vielzahl an Funktionen vor allem eine Stimulation der axonalen Aussprossung durch neu- rotrophe Faktoren induzieren [24, 3, 17]. Analog zur zellulären Komponente eines bioartifiziellen Nervenersatzes gab es auch verschiedenste Entwicklungen und Ideen auf dem Feld der Ma- terialforschung. So wurden in den zurückliegenden Jahrzehn- ten Trägermaterialien und Kombinationen aus Silikon, Meso- thel, Venen, Muskeln, Polyglykolsäure (PGA), Trimethylkar- bonat (Maxon), Poly-Laktat-Caprolakton (PLC), Polysulfone (PL), Matrigel, Polyamid-Nahtmaterial und vielen anderen Bio- trägern erprobt. Diese waren teils azellulär, teils mit Zellen be- siedelt (Schwannzellen, Stammzellen), mit neurotrophen Fak- toren (NGF und FGF), mit Proteinen wie Kollagen, Laminin, oder mit Hormonen wie Testosteron kombiniert [24, 16-18].
Die Vielzahl der bisherigen Ansätze zur Entwicklung von ge- eigneten Nervenersatzmaterialien, konnte den Goldstandard der autologen Nerventransplantation nicht erreichen. Das Kon- zept der vorliegenden Studie beinhaltet daher die Exploration Abb 1: Schematische Darstellung der Veränderungen nach Nervendurchtrennung im PNS. A: Intakte Nervenfaser mit Neuron und Verbindung zum Ziel- organ (Muskel). Die Myelinscheide wird durch Schwannzellen gebildet; Gleichgewicht zwischen Myelinisierung und Wachstumsfaktoren. B: Axondurch- trennung mit Chromatolyse und Kernverlagerung im Neuron sowie Waller’ scher Degeneration im distalen Segment. Hochregulation von Wachstumsfak- toren und Phagozytose von Gewebe- und Zellresten. C: Atrophie des Zielorgans bei gleichzeitiger Proliferation von Schwannzellen für die Ausbildung ei- ner Leitschiene („Büngnersches Band“) für das regerenierende Axon aus dem proximalen Segment. D: Erfolgreiche Regeneration mit Re-Innervation des Zielorgans sowie Hochregulation der myelinisierenden Faktoren. E: Erfolglose Regeneration mit Neuronbildung. Das regenerierende Axon findet keinen An- schluss zum Zielorgan, das im Verlauf weiter atrophiert.
schine der Firma. Zwick GmbH & Co. (Ulm) durchgeführt. Die Proben wurden mit einer Einspannlänge von 50 mm und mit einer Prüfgeschwindigkeit von 50 mm/min geprüft.
Zellgewinnung und -kultur
Nach Durchführung der Narkose, zu Beginn mit Isofluran, Me- detomidin (Dormitor®, 0,3 ml/kg KG s.c.) und Ketamin (10 %, 0,6 ml/kg KG s.c.), wurde an isogenen Lewis-Ratten (weiblich, 250-300 g) in Bauchlage und nach einem dorsalen Hautein- schnitt die ischiokrurale Muskulatur unter vorsichtiger Präpa- ration dargestellt und längs gespalten (Abb. 4). Der Nervus ischiadicus wurde bis zu seiner Aufteilung in die Unterschen- keläste dargestellt und ein ca. 2,5 cm langes Segment unter Belassung des epineuralen Schlauches aus der Lewis-Ratte ent- nommen.
Unter sterilen Bedingungen wurde das Nervenstück vorsich- tig in ca. 1-2 mm lange Segmente zerkleinert, auf befeuchte- te 35 mm Kulturschalen ausplatiert und bei 37° C und 5 %iger CO2-Atmosphäre kultiviert. Nach 7 – 10 Tagen bildete sich ein konfluierender Monolayer aus auswandernden Zellen um die Explantate. Hierdurch resultierte eine Verringerung der Fi- broblastenzahl, die durch ein schnelles Auswandern aus den Explantaten und stetiges Umsetzen bewirkt wurde. Die Ner- venstücke wurden in neue Petrischalen mit frischem Medium venleitschiene“ bei peripheren Nervendefekten. Im folgenden
Versuchsansatz werden erste in-vitro Ergebnisse bei der Ent- wicklung einer synthetischen Nervenleitschiene aus resorbier- barem Polyglycolid (PGA) und Polylactid (PLA) in Verbindung mit einem Zellträger aus Fibringel und Schwannzellen unter- sucht.
Material und Methoden
Textile Gewirke
Die gewirkten Textilstrukturen wurden am Institut für Textil- technik der RWTH Aachen (ITA) mittels der Doppelraschelma- schine der Firma Karl Mayer (Abb. 2). generiert. Durch Varia- tion der Herstellungsparameter, wie z.B. der Auswahl der Grundmusterungen und der Nadelbelegung, können für die je- weiligen Zellen angepasste Strukturen mit unterschiedlicher Porosität hergestellt sowie mechanische Eigenschaften, wie z.B. Dehnung und Porosität, eingestellt werden.
Für die Herstellung der Schläuche aus PGA und PLA wurde die Teilung E30 verwendet und mit zwei Grundlegebarren und vier Musterlegebarren gearbeitet. Als Muster wurde eine dop- pelbelegte Trikotbindung verwendet. Als Endstruktur wurden Schläuche mit einem Innendurchmesser von ca. 1,7 mm und hoher Dichtigkeit gewählt (Abb. 3).
Für die Charakterisierung der mechanischen Eigenschaften der Gewirke wurde ein Zugfestigkeitstest an einer Zugprüfma-
Polylactid (PLA) Polyglycolid (PGA)
Garnfeinheit [dtex] 1800 2090
Festigkeit [N] ±SA 137,03 ±1,00 361,73 ±12,88
Bruchdehnung [%] ±SA 93,77 ±1,02 80,86 ±1,91
Festigkeit ∼feinheitsbezogen [cN/dtex] ±SA 7,61 ±0,06 17,33 ±0,62
zur Herstellung medizinischer Textilien.
Tabelle 1: Mechanische Eigenschaften des gewirkten Trägermaterials (n=5; MW±SA)
(DMEM + 1 % Penicillin/Streptomicin + 10 % fetales Kälber- serum) umgesetzt und zehn Tage lang kultiviert. Anschließend erfolgte eine Nervendissoziation mit 1,25 U/ml Dispase und 0,05 % Collagenase, so dass die gewonnenen Schwannzellen in Laminin-beschichteten T75-Flaschen kultiviert werden konn- ten (Medium: DMEM, FCS, Transferrin, bFGF, Heregulin, Fors- kolin, Insulin, Penicillin/Streptomycin). Nach Erreichen eines konfluenten Zellrasens erfolgte die Trennung von Schwann- zellen und Fibroblasten mittels magnetischer Zellseparation (Magnetic Assisted Cell Sorting – MACS; Fa. Miltenyi Biotec GmbH, Bergisch Gladbach). Hierfür wurden paramagnetische Microbeads, die an monoklonale Antikörper konjugiert und gegen den membranständigen low-affinity nerve growth fac- tor receptor p75 (p75-NGFR) gerichtet waren, verwendet [27]
Die von den Fibroblasten getrennte Schwannzellkultur ergab nach Antikörpermarkierung gegen das zytosolische Protein S100-ß (polyklonal, rabbit anti-rat, Anti-S100 [1:400 Ver- dünnung], Dako Cytomation©, Glostrup / Dänemark) eine im- munzytochemisch nachgewiesene Reinheit von ca. 97 %.
Erstellung der Verbundstruktur
Die Erstellung und Aushärtung der dreidimensionalen Fi- brin/Schwannzellen-Matrix erfolgte bei sterilen Bedingungen unter der Sterilbank. Dabei wurden die kultivierten Schwann- zellen (ca. 1,5 x 106Zellen) in die flüssige Thrombinkompo- nente (100µl) gebracht, die Fibrinogenkomponente (100µl) hin- zugefügt und mittels einer Kanüle in den gewirkten Textil- schlauch eingebracht. Auf diese Weise wurde die zellbesiedelte drei-dimensionale und ausgehärtete Fibrinmatrix vom gewirk- ten Schlauch (Länge: 2cm, Innendurchmesser: 1,7 mm) aus Poly- lactid (PLA) und Polyglycolid (PGA) eingeschlossen (Abb. 5).
Vitalitätsüberprüfung (Trypanblau, FDA & PI und XTT-Test) Für den späteren Einsatz der Verbundstruktur aus dem ge- wirkten Schlauch und der Fibringel/Schwannzell-Matrix in
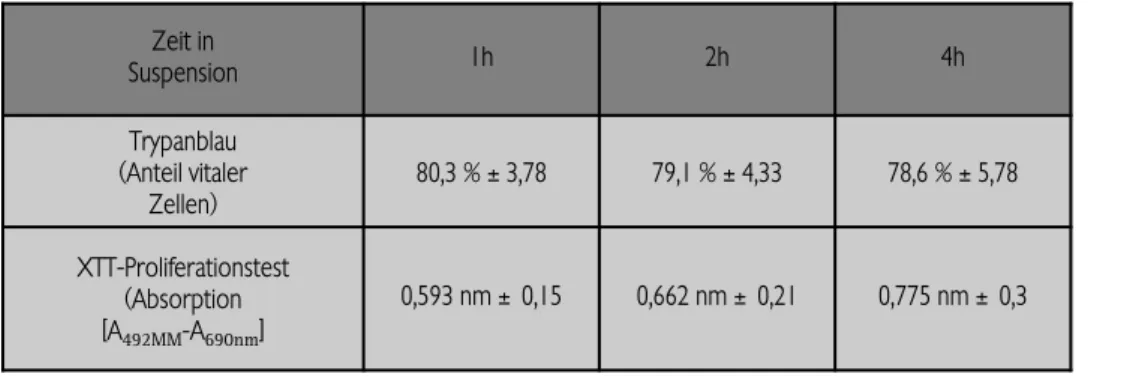
tierexperimentellen Versuchen ist es unerlässlich, dass die Schwannzellen in der Thrombinlösung für einen Zeitraum von mindestens vier Stunden überlebensfähig sind. Dieser Zeitraum beginnt ab dem Punkt der Erstellung bzw. Aushärtung der Ver- bundstruktur und endet zum Zeitpunkt der Implantation im Tiermodell. Von daher erfolgte eine Überprüfung der Vitali- tätsrate von Schwannzellen in Thrombin in einem Dreifach- ansatz: Die Schwannzellen wurden in einer Konzentration von 4,5 x 106pro 300µl Thrombin gelöst. Nach einer, zwei und vier Stunden wurden jeweils 20µl der Suspension entnommen und (i) mit 0,4 % Trypanblau-Lösung versetzt und der Anteil avitaler Zellen quantitativ bestimmt, (ii) mit Fluoreszeindia- cetat (FDA) & Propidiumjodid (PI) angefärbt und die Vitalität qualitativ bestimmt und (iii) mit dem XTT-Test die Zellproli- feration bzw. die Stoffwechselaktivität quantifiziert.
Zur Bestimmung der Vitalitätsrate wurden bei der Trypan- blaufärbung nach einer, zwei und vier Stunden die Schwann- zellen mit einer 0,4 % Trypanblau-Lösung (Sigma, München) angefärbt und der Anteil avitaler Zellen in der Neubauer-Zähl- kammer ermittelt. Avitale Zellen sind für Trypanblau permea- bel und nehmen den Farbstoff auf, während lebendige Zellen ungefärbt bleiben:
Vitalitätsrate = [(Zahl der lebenden Zellen) / (Gesamtzellzahl)]
x 100 %.
Bei der Vitalfärbung mit FDA und PI wird eine Unterschei- dung von vitalen (=grünen) und avitalen (=roten) Zellen er- möglicht. Die Inkubation der Thrombinlösung erfolgte bei ab- gedunkelten Verhältnissen mit 100µl einer Stammlösung, die aus 3ml Ringerlösung und jeweils 50 µl FDA bzw. 50µl PI (MP Biomedicals, Eschwede) angesetzt wurde. Nach ca. 30 Mi- nuten bei 5 % CO2und 37 °C erfolgte die Darstellung an einem Fluoreszenzkmikroskop. In vitalen und metabolisch aktiven Zellen wird FDA zu Fluorescein umgesetzt. Diese Zellen er- scheinen unter UV-Licht grün. Bei apoptotischen oder toten Zellen wird der Kern durch Propidiumiodid angefärbt, wo- Abb. 3: Nervenleitschiene aus Polylactid (PLA) und Polyglycolid (PGA). (A: links) Makroskopische, (B: mitte) lichtmikrokopische und (C: rechts) rasterelek- tronenmikroskopische Darstellung.
Abb. 4:
Intraoperativer Situs mit Darstellung des proximal durchtrennten N. ischiadicus (A: links) und des Epineurium- schlauchs (B: rechts).
durch diese Zellen rot fluoreszieren.
Der XTT-Test, ein Tetrazolium-Proliferationsassay, beruht auf der Tatsache, dass vitale (metabolisch aktive) Zellen mit Hilfe der mitochondrialen Succinat-Tetrazolium-Reduktase den XTT- Ring (Farbe=gelb) zu Formazan (Farbe=orange) reduzieren.
Dieser Farbstoff ist wasserlöslich und kann mittels ELISA- Reader (photometrisch) quantifiziert werden. Die Absorption wird bei einer Testwellenlänge von 492nm sowie bei einer Re- ferenzwellenlänge von 620 nm gemessen.
Im vorliegenden Ansatz wurden nach einer, zwei und vier Stunden jeweils 150µl XTT-Lösung aus einer XTT-Stammlö- sung (5ml Kulturmedium + 2,5ml XTT-Reagenz; Fa. Roche Di- agnostic GmbH, Mannheim) zur Schwannzell-Thrombinlösung in six-well Kulturgefässen hinzugegeben und bei 5 % CO2und 37 °C im Brutschrank inkubiert. Aus dem Überstand wurden 100 µl abpipettiert und das gelöste Formazan bei 492nm im ELISA-Reader photometrisch quantifiziert. Die Anzahl an le- benden Zellen ist proportional zur Menge an gebildetem For- mazan.
Ergebnisse
Licht- und fluoreszenzmikroskopische Aufnahmen (Abb. 6) zeigten einen hohen Reinheitsgehalt der primären Schwann- zellkultur, die in die Fibrinmatrix eingebrachten wurde. Mor- phologische Kriterien für vitale Schwannzellen waren die Aus- bildung von (i) spitz-ovalären Zellsomata, (ii) bipolaren Zel- lausläufern, (iii) spezifischen Zell-Zellkontakten und (iv) typische fischgrätenartige parallele Ausrichtung (Abb. 6).
Nach Einbringung der Zellsuspension in die Thrombinkompo- nente ergab die Auszählung nach der Trypanblaufärbung, dass nach einer Stunde ca. 80,3% der eingebrachten Schwannzellen
und vier Stunden stabilisierten und somit eine Aufrechterhal- tung der metabolischen Aktivität als Zeichen der Zellvitalität aufwiesen (Tabelle 2).
Diskussion
Textile Gewirke
Zellträgerstrukturen auf textiler Basis repräsentieren eine be- sondere Form von Biomaterialien, da im Verhältnis zum ein- gesetzten Fremdmaterial ein relativ großes Volumen geschaf- fen werden kann [20]. Die Textilträger weisen eine hohe spe- zifische Oberfläche auf und können entsprechend der Art und Lokalisation des Gewebedefektes individuell und patienten- adaptiert gestaltet werden, d.h. sie können der jeweiligen Um- gebung (=Implantatbett bzw. Gewebedefekt) optimal angepasst werden. Durch Veränderung der Produktionsparameter kann die Porengröße variiert werden, wodurch adäquate Bedingun- gen für die Nährstoffversorgung der Zellen im dreidimensio- nalen Träger geschaffen werden können [15, 2, 7, 11]. Für die meisten Zellarten, insbesondere für Schwannzellen, ist die Ver- sorgung gerade zu Beginn der Zellbesiedlung und Implantation von entscheidender Bedeutung, da zu diesem Zeitpunkt die Ernährung allein über Diffusion stattfindet. Hierbei liegt ein besonderer Vorteil in der Möglichkeit Wachstums- und Diffe- renzierungsfaktoren an die Textilträger zu koppeln und somit optimale Bedingungen für die benötigte Zellvitalität und -proliferation zu schaffen [29, 30, 14]. Auf der anderen Seite stellt die pH-Veränderung während der Degradation einen Nachteil von resorbierbaren Biomaterialien auf PLA-Basis dar.
Die Resorption beginnt von innen nach außen und schließt mit einer Übersäuerung durch die freiwerdende Milchsäure ab [9, 13]. Dieses Phänomen der „Bulk-Reaktion“, d.h. der Auto- lyse mit verbundener säurekatalysierter Hydrolyse im Inneren der Laktidkörper, gilt daher als besonders problematisch. Im Vergleich zu anderen Bioträgern ist bei textilen Trägern je- doch davon auszugehen, dass die Milchsäurekonzentration re- lativ gering bleibt. Dies ist auf die Feinheit der Fasern und die hohe Porosität zurückzuführen, da nur relativ geringe Men- gen an Säure entstehen bzw. diese nicht schlagartig freige- setzt werden. Hierdurch besteht möglicherweise ein entschei- dender Vorteil der Textilträger gegenüber herkömmlichen Bio- träger auf PLA-Basis. Die Etablierung und Optimierung der Abb. 5: Eine Hüllstruktur aus PVC enthält den gewirkten Textilschlauch, in das
Fibringel mit den Schwannzellen zur Aushärtung gebracht wird.
Abb. 6: Lichtmikrospkopische Aufnahmen von Schwann- zellen unter Kulturbedingungen (A: links = 100x Ver- größerung) und immunfluoreszenzmikroskopische Auf- nahmen nach Antikörpermarkierung gegen S-100 (B:
rechts = 100x Vergrößerung; grün=S-100, blau=Dapi- Kernfärbung).
Zellbesiedlung auf geeigneten textilen Zellträgerstrukturen aus Polyglycolid (PGA) und Polylactid (PLA) wird aus diesen Grün- den angestrebt. Als textile Komponente wurden PGA und PLA verwendet, weil diese bereits für den klinischen Einsatz als chirurgisches Nahtmaterial zugelassen sind. Im direkten Ver- gleich ist die Resorptionszeit von PGA kürzer als die von PLA, was für die jeweilige klinische Fragestellung von Bedeutung sein kann.
Fibringel als Zellträger
Im Vergleich zu matrixfreien und mit NaCl angereicherten Konduiten wurde in mit Fibrin gefüllten Nervenleitschienen eine gesteigerte Regeneration nachgewiesen [28]. Fibrin stellt ein optimales Medium für die Kultivierung und Transplantation von Zellen dar, insbesondere von Schwannzellen; Untersu- chungen von unterschiedlichen Arbeitsgruppen konnten ei- nen proportionalen Zusammenhang zwischen der Fibrin-Kon- zentration und der Axonwachstumslänge von Spinalzellen nachweisen [1, 10, 23]. Im Gegensatz zu einem zweidimen- sionalen Gerüst, kommt es bei einem dreidimensionalen Fi- bringrundgerüst zu einem vermehrten Nervenfaserwachstum [21]. Fibrin hat dabei die Eigenschaft neurotrophe Faktoren gut zu speichern und langsam abzugeben, wodurch es sich als idealen Carrier qualifiziert [4].
Ausblick
Das Ziel unserer in-vitro Untersuchungen war die Entwick- lung eines zellulären Conduits aus resorbierbarem Polyglyco- lid und Polylactid in Verbindung mit einem Zellträger aus Fib- ringel und Schwannzellen. Diese Ergebnisse dienen als Grund- lage für den Einsatz im Tiermodell. Hierbei ist das N. ischiadicus Tiermodell an isogenen Lewis-Ratten vorgesehen. Nach der Gewinnung und Kultivierung von Schwannzellen aus Spen- dertieren werden die Schwannzellen in die flüssige Throm- binkomponente gebracht, mit der Fibrinogenkomponente ver- eint und mittels einer Kanüle in den gewirkten Textilschlauch eingebracht. Die so hergestellte künstliche Nervenleitschiene
(Abb. 5) wird bei Empfängertieren in einen 2cm langen De- fekt des N. ischiadicus mikrochirurgisch eingesetzt (Abb. 4).
Im Verlauf und am Ende eines Beobachtungszeitraumes von 6 bzw. 12 Wochen dienen funktionelle und elektrophysiologi- sche Tests sowie histologische, morphometrische und elektro- nenmikroskopische Untersuchungen der Beurteilung der Ner- venregeneration. Als Vergleich dient auch hier der Goldstan- dard, die autologe Nerventransplantation.
Abstract
Current clinical strategies to treat large nerve defects require autologous nerve grafts (e.g. sural nerve) to promote nerve re- generation. This derives from the knowledge that viable Schwann cells with their neurotrophic and neurotopic factors play a crucial role in the axonal regeneration of peripheral nerves. Following extensive damage to peripheral nerves, the technique of autologous nerve transplantation is, however, li- mited by donor site morbidity and, especially, by the quanti- ty or availability of autograft material. Artificially synthesi- zed nerve grafts may therefore be used to help overcome this limitation.
The long term goal of the current project was to develop an ar- tificial, biocompatible and flexible nerve graft made of Poly- lactide (PLA) and Polyglycolic acid (PGA) to induce regene- ration in the peripheral nervous system. A prerequisite for this model is the presence of viable Schwann cells prior to im- plantation. Here, we could show that primary Schwann cell cultures displayed typical morphology with bipolar dendrites and oval cell bodies. Furthermore, after suspension in throm- bin, harvested Schwann cells remained viable as proved by Trypan blue as well as Fluorescein and Propidium Iodide stai- ning and by XTT measurements.
In summary, we present a simple method to build a three-di- mensional construct for use as an epineurium replacement containing homogenous and viable Schwann cells for enhan- cing and promoting peripheral nerve regeneration.
Zeit in
Suspension 1h 2h 4h
Trypanblau (Anteil vitaler
Zellen)
80,3 % ±3,78 79,1 % ±4,33 78,6 % ±5,78
XTT-Proliferationstest (Absorption [A492MM-A
690nm]
0,593 nm ± 0,15 0,662 nm ± 0,21 0,775 nm ± 0,3
Tabelle 2:
(A) Ermittlung der Überlebensrate von Schwannzellen in der Throm- binlösung mittels Trypanblaufärbung (MW
±
SD; n=5) und(B) Ermittlung der metabolischen Ak- tivität mittels XTT-Test (MW±SA; n=5).
Abbildung 7: Vitalitätsfärbungen mit Fluoreszeindiace- tat (A: links = FDA) und Propidiumjodid (B: rechts = PI) zur Darstellung von vitalen (=grün) und avitalen (=rot) Schwannzellen.
entwickeln und herstellen Kettenwirk -Praxis 35, H.2, S. 44-46, 2001
[3] Bryan D.J., Wang K.K., Chakalis-Haley D.P.: Effect of Schwann cells in the enhancement of peripheral nerve rege- neration. Plast Reconstr Surg; 12 (7): 439-446, 1996
[4] Cheng H., Fraidakis M., Blomback B., Lapchak P., Hoffer B., Olson L.: Characterization of a fibrin glue-GDNF slow- release preparation. Cell Transplant; 7: 53-61, 1998
[5] Dubovz P.: Schwann cells and endoneurial extracellular matrix molecules as potential cues for sorting of regenerated axons: A review. Anatomical Science International; 79: 198–
208, 2004
[6] Fansa H., Keilhoff G.: Factors influencing nerve regene- ration. Handchir Mikrochir Plast Chir; 35: 72-82, 2003 [7] Fuchs H., Dresbach H., Autschbach R., Zwadlo-Klarwas- ser G., Jockenhoevel S.: Combining Growth Factors with Fibrin Gel Matrices for Cardiovascular Tissue Engineering. Int. J Ar- tif. Organs; 26(7): 662, 2003
[8] Gulati A.A.: Evaluation of acellular and cellular nerve grafts in repair of rat peripheral nerve. J Neurosurg; 68: 117- 123, 1988
[9] Hojo Y., Kotani Y., Ito M., Abumi K., Kadosawa T., Shi- kinami Y., Minami A.: A biomechanical and histological eva- luation of a bioresorbable lumbar interbody fusion cage; Bio- materials 26(15):2643-51, 2005
[10] Horch R.E., Bannasch H., Kopp J., Andree C., Stark G.B.:
Single-cell suspensions of cultured human keratinocytes in fi- brin-glue reconstitute the epidermis. Cell Transplant; 7: 309- 317, 1998
[11] Hutmacher D. W., Schantz T., Zein I., Ng K. W., Teoh S. H., Tan K. C.: Mechanical properties and cell cultural response of polycaprolactone scaffolds designed and fabricated via fused deposition modeling. J. Biomed. Mater. Res. 2001
[12] Joseph N.M, Mukouyama Y.S., Mosher J.T., Jaegle M., Crone S.A., Dormand E.L., Lee K.F., Meijer D., Anderson D.J., Morrison S.J.: Neural crest stem cells undergo multilineage differentiation in developing peripheral nerves to generate endoneurial fibroblasts in addition to Schwann cells. Deve- lopment; 131: 5599-5612, 2003
[13] Kallela I., Laine P., Suuronen R., Lindqvist C., Iizuka T.:
Assessment of material- and technique-related complications following sagittal split osteotomies stabilized by biodegrada- ble polylactide screws; Oral Surg Oral Med Oral Pathol Oral Radiol Endod.99(1):4-10, 2005
[14] Klee D. et al.: Surface modification of poly(vinylidene- fluoride) to improve the osteoblast adhesion. Biomaterials;
24:3663-3670, 2003
[15] Linnemann B., Sri Harwoko M., Gries Th.: Polylactide fi- bres (PLA); Chemical Fibres International, S.426, 12/2003 [16] Lundborg G.: A 25-year perspective of perpheral nerve surgery: Evolving neuroscientific concepts and clinical signi- ficance. J Hand Surg; 391-414, 2000
[17] Lundborg G.: Alternatives to autologous nerve grafts.
Handchir Mikrochir Plast Chir; 36: 1-7, 2004
[18] Meek M.F, Coert J.H.: Clinical use of nerve conduits in peripheral nerve repair: Review of the literature: J Reconstr Microsurg; 18:97-109, 2002
[19] Millesi H., Berger A.: Experimentelle Untersuchungen zur Heilung durchtrennter peripherer Nerven. Chir Plast; 1: 174- 177, 1972
[20] Paz R. M. P.: Studien zur kontrollierten Freisetzung bio- logisch aktiver Substanzen aus resorbierbaren Nano- und Mikrosphären; Dissertation RWTH Aachen; 101, 11/2004 [21] Sakiyama S.E., Schense J.C., Hubbell J.A.: Incorporation of heparin-binding peptides into fibrin gels enhances neurite extension: an example of designer matrices in tissue enginee- ring. FASEB; 13: 2214-2224, 1999
[22] Samii M.: Die operative peripherer Nervenverletzungen.
Therapie Woche; 27: 2164, 1972
Telefon: 0241-800
E-Mail: abozkurt@ukaachen.de
Akademischer Lebenslauf
1997-2002 Studium der Humanmedizin an der Hein- rich Heine–Universität in Düsseldorf 2002-2003 Studium der Humanmedizin an der
RWTH Aachen
2004 Dissertation „ In-vitro Rezeptorautora- diographie und Konnektivitätsanalysen des Gyrus cinguli bei Makaken“ (am C.
& O. Vogt Institut für Hirnforschung der Heinrich Heine–Universität in Düssel- dorf)
seit Januar 2004 Wissenschaftlicher Angestellter an der Klinik für Plastische Chirurgie, Hand- und Verbrennungschirurgie (Forschungs- schwerpunkt: Periphere Nervenregene- ration)
[23] Schense J.C., Hubbell J.A.: Cross-linking exogenous bi- functional peptides into fibrin gels with factor XIIIa, Biocon- jug Chem; 10: 75-81, 1999
[24] Sparmann M.: Nervenprothetik. Der Orthopäde; 27: 433- 440, 1998
[25] Sunderland S.: The anatomy and physiology of nerve in- jury. Muscle Nerve; 13: 771-784, 1990
[26] Terzis J.K., Sun D.D., Thanos P.K.: Historical base scien- ce review: Past, present, and future of nerve repair. J Reconstr Microsurg; 13: 215-225, 1997
[27] Vroemen M., Norbert W.: Purification of Schwann cells by selection of p75 low affinity nerve growth factor receptor ex- pressing cells from adult peripheral nerve. J Neurosci Methods;
124: 135-143, 2003
[28] Williams L.R., Danielsen N., Muller H., Varon S.: Exoge- nous matrix precursors promote functional nerve regenera- tion across a 15-mm gap within a silicone chamber in the rat.
J Comp Neurol; 264: 284-290, 1987
[29] Wintermantel E. et al.: Biomaterialien - humane Toleranz und Integration. In: Chirurg 70, 8, 847-857, 1999
[30] Wintermantel E., HA S.-W.: Medizintechnik mit biokom- patiblen Werkstoffen und Verfahren: Springer Verlag, Berlin 2002